Водородный показатель (рН)
Вода ведет себя как амфолит, т.е. при диссоциации образуются и катион водорода, и гидроксид-ион: H2O ↔ H+ + OH−
Кд (H2O) = где а( Н+), а( ОН− ), а( Н2О) − активности ионов Н+, ОН− и воды. Степень диссоциации воды очень мала, поэтому активности ионов водорода и гидроксид-ионов в чистой воде практически равны их концентрациям. Так как вода присутствует в большом избытке, ее концентрация может считаться постоянной и составляет 55, 6 моль/л (1000 г: К (H2O) = [H+][OH− ] = 10− 14 моль2/л2 при 298 К. Константа К (H2O) называется ионным произведением воды. В чистой воде или любом водном растворе при постоянной температуре произведение концентраций (активностей) водород- и гидроксид-ионов − величина постоянная, называемая ионным произведением воды. Константа К (H2O) зависит от температуры. При повышении температуры К (H2O) увеличивается, так как процесс диссоциации воды – эндотермический. В чистой воде при 298 К активности а (Н+) = а (ОН− ) = 1∙ 10-7 моль/л, как это следует из равенства: [H+] = [OH− ] = Растворы, в которых концентрации водород- и гидроксид-ионов равны, называют нейтральными. Концентрации гидроксид- и водород-ионов взаимозависимы: зная концентрацию одного из этих ионов, можно рассчитать концентрацию другого иона. В качестве характеристики реакции среды часто используют концентрацию ионов водорода. На практике использование концентраций ионов не очень удобно, поэтому для характеристики среды используют отрицательный десятичный логарифм концентрации (активности) ионов водорода, называемый водородным показателем рН среды: pH = –lg[H+] Например, если [H+] = 10− 3 моль/л (кислая среда), то рН = 3; а когда [H+] = 10− 9 моль/л (щелочная среда), то рН=9. В нейтральной среде [H+] = 10− 7 моль/л и рН=7.
Из этих примеров следует: - в нейтральной среде [H+] = [OH− ] = 10− 7 моль/л, рН=7; - в кислой среде [H+] > 10− 7 моль/л, рН< 7; - в щелочной среде [H+] < 10− 7 моль/л, рН> 7. Если взять отрицательный десятичный логарифм выражения ионного произведения воды, получаем: –lg К (H2O) = –lg[H+] – lg[OH− ] = – lg10− 14 рН + рОН = 14.
|


 = 1, 8∙ 10-16моль/л,
= 1, 8∙ 10-16моль/л,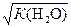 =
= 



