ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ. • Пример 1.1.При сжигании 2,24л метана выделилось 90 кДж тепла
• Пример 1.1. При сжигании 2, 24л метана выделилось 90 кДж тепла. Определить теплоту образования и теплоту сгорания метана (вода образуется в виде жидкости) Решение: Термическое уравнение реакции
0, 1CH4(г) +0, 2O2(г)0, 1CO2(г)+0, 2H2O(ж)+90 кДж (1) или CH4(г)+2O2(г)CO2(г)+2H2O(ж)+900 кДж (2) (уравнения справедливы с учетом того, что объем метана V=2, 24л выражен в молях. Объем 1 моля идеального газа в стандартных условиях 22, 4л). Согласно определению теплоты сгорания (см.раздел 1) из уравнения (2) следует то что теплота сгорания метана =-900кДж/моль. Для вычисления теплоты образования воспользуемся следствием из закона Гесса: . Значения для теплоты образования двуокиси углерода и теплоты образования паров воды приведены в таблице П.1 приложений. Для реакции (2) уравнение выглядит следующим образом: . Откуда. Ответ: теплота сгорания метана =-900; теплота образования метана. • Пример 1.2. Вычислить теплоту образования серной кислоты из следующих данных: (1) H2(г)+0, 5O2(г)H2O(ж)+286 кДж ( (2) S(Т6)+O2(г) SO2(г)+297 кДж( (3) SO2(г)+0, 5O2(г) SO3+99 кДж( (4) SO3(г)+H2O(ж) H2SO4(ж)+132 кДж( Решение: I способ. Основан на определении теплоты образования вещества. Согласно определению, теплота образования серной кислоты есть тепловой эффект реакции: H2(г)+2O2(г)+S(т6) H2SO4(ж)+. Величина есть теплота образования H2SO4. (Заметим, что реакцию (5) провести в одну стадию невозможно). Термохимические уравнения –обычные алгебраические уравнения, в которых под химическими формулами реагентов подразумевается их теплоты образования. В приведенном примере легко заметить, что суммирование уравнений (1), (2), (3), (4) приводит к уравнению (5).Следовательно, есть сумма:
(Знак “-” указывает на то, что тепло выделяется). II способ. Основан на применении закона Гесса. Для определения теплоты образования H2SO4 из термохимического уравнения (4) необходимо знать теплоту образования SO3(г)и теплоту образования H2O(ж) Согласно определению теплоты образования тепловой эффект реакции (1)- это теплота образования H2O(ж) а реакции (2) -теплота образования SO2(г).Тогда, применяя следствие из закона Гесса к реакции (3) можно вычислить теплоту образования SO3(г): или. Теперь, применим следствие из закона Гесса к реакции (4)
Откуда. Ответ: теплота образования серной кислоты.
• Пример 1.3. Оценить интервал температур, при которых возможно самопроизвольное восстановление тетрахорда кремния водородом. Решение. Термохимическое уравнение реакции: SiCl4(ж)+2H2(г)Si(т6)+4HCl(г)+. Речь идет о самопроизвольном протекании прямой реакции. Термодинамическим критерием возможности самопроизвольного протекания реакции является отрицательное значение энергии Гиббса. Таким образом, вопрос заключается в определении (оценке) интервала температур, при которых прямой реакции принимает отрицательные значения.Для этого воспользуемся уравнением (1.21) (см. Раздел 1 МУ и КЗ)
Полагая ине зависящими от температуры (т.е), рассчитаем их пользуясь данными таблицы П1 и законом Гесса:
) Согласно принятым допущениям зависимость энергии Гиббса от температуры имеет вид: -прямая пропорциональная Тогда при T=00KкДж, условия равновесия (Δ G=0) . Таким образом, прямой реакции становится отрицательной при T> 10820К. Ответ: самопроизвольное восстановление тетрахорда кремния водородом возможно при температуре больше 10820K(809).
• Пример 2.1. Как повлияет на равновесие в системе2H2(г)+S2(г)2H2S(г): • Повышение парциального давления водорода • Увеличение объёма газовой смеси • Нагревание системы • Записать выражение для константы равновесия. ВыражениеK для стандартной температуры и для температуры 10000K. Решение: 1.Увеличение парциального давления водорода в соответствии с принципом Ле Шателье — Брауна сместит равновесие в сторону реакции, в результате которой избыток водорода будет расходоваться, т.е. в сторону прямой реакции (скорость прямой реакции возрастет). 2.Увеличение объёма газовой смеси равносильно понижению парциальных давлений всех газов в системе. В соответствии с принципом Ле Шателье — Брауна такое воздействие приведет к снижению равновесию в сторону обратной реакции, т.к. суммарный объем паров серы и водорода (3моля) больше объема H2S (2 моля). Т.е. скорость разложения H2S станет больше скорости его синтеза. 3.Для ответа на третий вопрос необходимо знать тепловой эффект реакции. Для прямой реакции величина стандартного теплового эффекта, вычисляется на основе закона Гесса: , т.е. прямая реакция экзотермическая. Тогда в соответствии с принципом Ле Шателье — Брауна при нагревании равновесной системы равновесие смещается в сторону реакции, в результате которой тепло поглощается, т.е. в сторону обратной реакции (разложение сероводорода). 4.Выражение для константы равновесия данной системы: . Согласно основному уравнению термодинамики (уравнение (2.4): . Величина изменения свободной энергии Гиббса, в соответствии с законом Гесса (табл. П1)
Для температуры 10000Kвеличина константы равновесия
(табл. П1),
. Уменьшение величины K при увеличении температуры говорит о смешении равновесия в сторону обратной реакции.
• Пример 3.1. В 10л воды растворено 0, 23 г металлического натрия: а)вычислить величину водородного показателя полученного раствора; б)рассчитать, какой объем раствора соляной кислоты с рН=0 потребуется для нейтрализации полученного раствора. Решение а) Уравнение реакции растворения натрия в воде Na(кр)+2H2O(ж)2NaOH(р-р)+H2(г). Или в ионной форме Na(кр)+2H2O(ж)2Na+(aq)+2OH-(aq)+H2(г). Полученный раствор – раствор щелочи (NaOH) – сильный электролит. В соответствии с уравнением реакции при растворении 1 моля натрия образуется 2 моля ионов OH-. Тогда по условию задачи содержание ионов OH-составляет 2*10-3 моль/л. Равновесная концентрация ионов OH-в растворе: . Согласно уравнениям (3.10) и (3.14) водородный показатель реакции
в)Уравнение реакции нейтрализации: NaOH+HClNaCl+H2O. Или в ионной форме Na++OH-+H++Cl-Na++Cl-+H2O. OH-+H+H2O. Т.е. общее содержание ионов H+в растворе кислоты: Vщелочи*[OH-]=Vкислоты*[H+]. Откуда Vкислоты=Vщелочи*. По условию рН соляной кислоты равен 0, тогда: pH=или 0= , Следовательно, Vкислоты Ответ: a) pH=11, 3; б)VHCl=20 мл.
• Пример 3.2. Определить величину водородного показателя раствора, полученного при растворении 2, 24л газообразного фторида водорода в 10 л воды. Решение. При растворении HF(г) в воде образуется слабая фтороводородная (плавиковая) кислота. Считая HF идеальным газом, рассчитаем молярную концентрацию полученного раствора. Молярный объём идеального газа в стандартных условиях составляет 22, 4 л/моль.Поэтому концентрация раствора плавиковой кислоты составляет: . Поскольку плавиковая кислота слабая (Kg=6, 6*10-4), ее концентрация отличается от концентрации ионов H+в растворе. Для расчета [H+] воспользуемся законом разведения Отсвальда и уравнением (3.9) . Тогда
Ответ: pH=2, 59. Примечание: Для сравнения рекомендуем провести расчет pH сильной кислоты (например, HJ) той же концентрации. • Пример 3.3. Оценить величину водородного показателя водного раствора в 10л которого содержится 424г хлорида лития.Как изменится pH, если концентрацию соли понизить в 2 раза? Решение: Хлорид лития – соль образованная катионом слабого снования LiOH (Kg=6, 7*10-1) и сильной соляной кислоты HCl. Поэтому гидролиз будет протекать в сторону образования слабо диссоциированного основания. Схема гидролиза LiCl+HOHLiOH+HCl или в ионной форме Li++Cl-+HOHLiOH+H++Cl- Таким образом, в растворе создается избыточная концентрация ионов H+, и реакция раствора будет кислой (pH< 7). Оценим величину водородного показателя. Концентрация хлорида лития в растворе (моль/л) составляет: . Тогда в соответствии с уравнениями (табл. 3) константа гидролиза , степень гидролиза
и При увеличении концентрации LiCl в 2 раза (до 2 моль/л) степень гидролиза уменьшиться в раз, а величина рН станет: . Ответ а)pH=6, 8 б) pH1=6, 15.
• Пример 4.1. Внешний (валентный) электронный слой элемента (Э) описывается значениями квантовых чисел п=3, 1=0, 1. Высший оксид элемента отвечает формуле ЭОз. Определить этот элемент и записать его электронную формулу. Решение. Значение главного квантового числа соответствует номеру периода, в котором расположен элемент. Значения орбитального квантового числа указывают на то, что валентными являются s и р электроны. Высшая валентность элемента, исходя из формулы его оксида, равна 6, т.е. элемент входит в шестую группу периодической системы элементов. Следовательно, этот элемент - сера (8). Электронная формула серы: 1S22S22р63S23р4.
• Пример 5.1а Пользуясь таблицей стандартных электродных потенциалов, записать уравнение окислительно-восстановительной реакции
Решение. Определим, какие ионы являются в данной реакции окислителем и восстановителем. В данной реакции участвуют следующие анионы и катионы:
Рассмотрим функции каждого из них. • Соответствующая электродная реакция Стандартный потенциал •
• Электродная реакция • •
Таким образом, восстановителем в данной реакции является ион I-, а окислителем тот ион, окислительно-восстановительный потенциал которого наиболее положительный, т.е.
эдс реакции (раздел «Электрохимия») равна:
Эта величина положительна, значит реакция возможна.
Коэффициенты 1 и 3, на которые умножаются соответствующие полуреакции, уравнивают число отданных и принятых электронов. Суммируя эти уравнения, получим уравнение реакции в ионном виде:
Так как в кислой среде ионы металлов с ионами кислотного остатка дают соли, то окончательно получим:
• Пример 5.1б Записать уравнение окислительно-восстановительной реакции: 1. Восстановителем в этой реакции является медь. 2. Окислителем является перекись водорода. 3. Реакция происходит в кислой среде (НСl). 4. В системе имеются анионы хлора Сl-. В табл. П3 «Таблица стандартных электродных потенциалов» находим электродные реакции для восстановителя и окислителя: Восстановитель: Сu + Сl- - еСuСl ° = 0, 124 В. Окислитель: Н2O2 + 2Н+ + 2е 2Н2O ° = 1, 78 В. ЭДС реакции Е == 1, 78-0, 124=1, 656 В. Величина Е> 0, что указывает на возможность самопроизвольного протекания реакции в прямом направлении, т. е. медь может окисляться перекисью водорода в присутствии анионов хлора. 2| Сu + Сl- - е СuСl 1|H2O2 + 2Н+ + 2е2Н2O 2Сu + 2Сl- + 2Н++Н2O22СuСl + 2Н2O. Окончательно получим: 2Сu + Н2O2 + 2НСl 2СuСl + 2Н2О. • Пример 5.2. Определить время электрохимического меднения, необходимое для нанесения пленки меди толщиной 10 мкм при плотности тока j = 10-2 А/м. Выход по току η = 100%. Записать уравнение катодной реакции. В основе расчетов лежат законы Фарадея (законы электролиза). 1. При электролизе количество вещества, участвующего в химических превращениях, пропорционально количеству электричества, прошедшего через электролит. 2. Массы веществ, выделяемых или растворяемых одним и тем же количеством электричества, пропорциональны их химическим эквивалентам. Уравнение катодной реакции: .
Математически первый закон Фарадея выражается уравнением: , где m - масса реагирующего вещества, кг; К - электрохимический эквивалент вещества, г/экв*Кл; η – выход по току. С другой стороны, масса пленки меди толщиной d на пластинке с площадью S равна: где ρ – плотность меди, 8, 9*103 кг/м3 (табл. П2) Электрохимический эквивалент меди: , где М=63, 5*10-3 кг/мольCu, n - заряд катиона =2. F - число Фарадея =96480Кл. Количество пропущенного электричества Q связано с плотностью тока и временем процесса соотношением: Q = I*τ = j*S*τ, где τ – время электролиза, с; I – сила тока, А; j - плотность тока (А/м2); S – площадь сечения, м2.
Таким образом, уравнение закона Фарадея принимает следующий вид: j*S*τ *ή или . Ответ: τ = 2640, с = 44 мин.
|

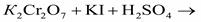

 - ион щелочного металла в высшей степени окисления, следовательно, может выполнять только функции окислителя.
- ион щелочного металла в высшей степени окисления, следовательно, может выполнять только функции окислителя. .
.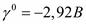 .
. - ион, содержащий в своем составе Сг6+, имеющий высшую степень окисления, может являться только окислителем. Электродная реакция
- ион, содержащий в своем составе Сг6+, имеющий высшую степень окисления, может являться только окислителем. Электродная реакция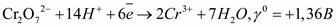 .
. - ион йода в низшей степени окисления, следовательно, может выступать только в роли восстановителя.
- ион йода в низшей степени окисления, следовательно, может выступать только в роли восстановителя.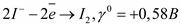 .
. - ион водорода в высшей степени окисления; может быть только окислителем
- ион водорода в высшей степени окисления; может быть только окислителем 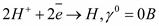 .
.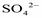 - ион, содержащий серу в высшей степени окисления +6, поэтому может быть только окислителем. Соответствующие реакции:
- ион, содержащий серу в высшей степени окисления +6, поэтому может быть только окислителем. Соответствующие реакции: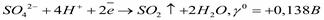

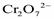 . Таким образом, можно записать для окислителя и восстановителя:
. Таким образом, можно записать для окислителя и восстановителя: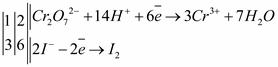
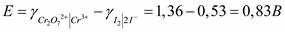 .
.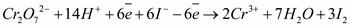 .
.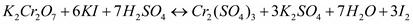 .
.


