В изолированных системах самопроизвольные процессы могут протекать только в направлении возрастания энтропии, а в состоянии равновесия энтропия имеет максимальное значение
2. 3. 2. 3. Изменение энтропии при нагревании В изобарных условиях (Р = const)теплота процесса равна изменению энтальпии, и тогда
Изменение энтропии при нагревании Δ S нагр. от температуры T 1 до температуры T 2:
Если использовать средние теплоемкости в интервале температур от T 1 до T 2, то изменение энтропии при нагревании, может быть рассчитано как
Так как T 2 > T 1, то Δ S нагр.> 0, т. е. при нагревании энтропия возрастает. Это соответствует физическому смыслу энтропии, так как при повышении температуры скорость хаотичного движения молекул возрастает.
2. 3. 2. 4. Изменение энтропии при фазовых превращениях Фазовые превращения (плавление, испарение, возгонка и др.) происходят при неизменных температуре и давлении, поэтому в общем виде изменение энтропии при фазовом превращении Δ S ф.п. равно
Процессы плавления (твердое вещество → жидкость), испарения (жидкость → газ) и возгонки (твердое вещество → газ) протекают с поглощением тепла, т.е. в этих процессах Δ H ф.п. > 0. Поэтому при плавлении, испарении и возгонке энтропия возрастает, что так же соответствует ее физическому смыслу. Изменение энтропии в процессах фазовых переходах происходит скачком при температуре данного фазового перехода. 2. 3. 2. 5. Расчет абсолютной энтропии вещества В отличие от внутренней энергии и энтальпии расчет абсолютного значения энтропии оказывается возможным. Это следует из постулата Планка: Энтропия идеального (не имеющего дефектов) кристалла при температуре абсолютного нуля равна нулю (ST =0 = 0) . Таким образом, энтропия вещества при температуре равна:
Если с веществом при нагревании от абсолютного нуля не происходит фазовых или агрегатных превращений, то абсолютная энтропия при температуре T равна:
где CP , тв. – изобарная теплоемкость твердого вещества а идеальном кристаллическом состоянии. Если в интервале температур от 0 К до Т с веществом происходят фазовые или агрегатные превращения, то для вычисления абсолютной энтропии вещества при температуре Т нужно знать его теплоемкости в различных агрегатных (фазовых) состояниях, температуры и теплоты этих превращений. Тогда значения абсолютной энтропии при любой температуре T может быть рассчитано по уравнению:
По этому уравнению рассчитаны абсолютные энтропии для многих веществ при стандартных условиях (
2. 3. 2. 6. Изменение энтропии при химическом превращении Поскольку энтропия является функцией состояния, то изменения энтропии в ходе химической реакции можно рассчитать как разность сумм энтропий продуктов реакции (конечных веществ) и реагентов (исходных веществ):
Пользуясь значениями стандартных энтропий веществ, изменение энтропии при протекании химической реакции в стандартных условиях можно рассчитать по формуле:
Изменение энтропии при химическом превращении при любой температуре T и стандартном давлении можно рассчитать исходя из зависимости энтропии каждого вещества, участвующего в реакции, от температуры. С использованием средних теплоемкостей изменение энтропии системы при протекании в ней химической реакции рассчитывается по уравнению:
2. 3. 3. Применение второго начала термодинамики к химическим процессам. 2. 3. 3. 1. Термодинамические потенциалы Большинство процессов в химической технологии осуществляется в изобарно-изотермических условиях (Р = const, Т = const) в закрытых аппаратах, которые можно рассматривать как закрытые системы. В закрытых системах в отличие от изолированных δ Q ≠ 0. Работу процесса можно представить в виде суммы
где В обратимом процессе работа является максимально возможной, поэтому
где В соответствии с первым и вторым началами термодинамики для обратимого процессаможем записать
или
Это выражение называется объединённым уравнением первого и второго начал термодинамики, из него следует, что
Обозначим разность (H – TS) как G и получим
Таким образом, максимальная полезная работа в изобарно-изотермических условиях равна изменению термодинамической функции, которая получила название свободная энергия Гиббса (изобарно-изотермический потенциал) и условно обозначается буквой G. Для изохорно-изотермических условий (V = const, P = const) dV = 0, поэтому
Таким образом, максимальная полезная работа в изохорно-изотермических условиях равна изменению термодинамической функции, которая получила название свободная энергия Гельмгольца (изохорно-изотермический потенциал) и условно обозначается буквой A. Большинство процессов в химико-технологических системах протекают в изобарно-изотермических условиях, для которых максимально полезная работа в ходе обратимого процесса равна убыли энергии Гиббса:
Энергия Гиббса является функцией состояния. Изменение энергии Гиббса представляет собой ту часть полной энергии системы, которую в принципе можно превратить в максимальную полезную работу и является суммарной движущей силой процесса в изобарно-изотермических условиях. В необратимых процессах работа всегда меньше, чем в обратимых. Тогда для необратимого и самопроизвольного процесса справедливо неравенство
или для конечного процесса
Изменение энергии Гиббса в конечном процессе можно рассчитать как
откуда
Это выражение также является математическим выражением второго начала термодинамики. Из него следует, что теплота (Δ H) может быть лишь частично превращена в работу, которую характеризует свободная энергия Гиббса (Δ G). Функция T Δ S тепло, которое не может быть превращено в работу, T Δ S называется связанной энергией. 2. 3. 3. 2. Уравнение Гиббса-Гельмгольца Возьмем полный дифференциал от энергии Гиббса
Если считать, что в процессе совершается только механическая работа расширения газов, то объединенное уравнение первого и второго начал термодинамики для обратимого процесса может быть записано как
Тогда выражение для полного дифференциала энергии Гиббса примет вид:
Из полученного выражения следует, что частная производная энергии Гиббса по температуре при постоянном давлении равна:
Для конечного обратимого процесса:
Если подставить полученное выражение в уравнение для изменения энергии Гиббса
получим уравнение, которое носит название уравнения Гиббса-Гельмгольца:
2. 3. 3. 3. Критерии направления процессов в закрытых системах Изменение энергии Гиббса и Гельмгольца служит не только мерой максимально полезной работы, совершаемой в процессе, но является критерием направления самопроизвольного процесса в закрытых системах. При осуществлении самопроизвольного процесса система в состоянии произвести работу. Например, при работе гальванического элемента (первичного источника тока или аккумулятора) за счет самопроизвольного протекания химических реакций на электродах система производит электрическую работу. При этом
Аналогично можно показать, что в изохорно-изотермических условиях критерием возможности самопроизвольного процесса является:
Таким образом, если в изолированных системах о направлении самопроизвольного процесса судят по изменению энтропии (п. 2. 3. 4), то в закрытых системах, какими являются большинство химико-технологических систем, ответ на этот вопрос получают на основании изменения энергии Гиббса или энергии Гельмгольца: В закрытых системах самопроизвольные процессы могут протекать только в направлении уменьшения энергии Гиббса (при P = const и T = const) или энергии Гельмгольца (при V = const и T = const), а в состоянии равновесия эти функции имеют минимальное значение. На практике большинство процессов совершается при постоянных давлении и температуре, поэтому на первом молекулярно-кинетическом уровне анализа ХТС обязательно рассчитывают изменение энергии Гиббса для химических реакций, протекающих в системе. Пойдет реакция самопроизвольно или нет, очень важно знать для выбора аппаратов и построения структуры ХТС. 2. 3. 4. Химический потенциал идеального и реального газа. Термодинамическая активность. Если взять полный дифференциал от выражения
получим
Если максимальная полезная работа
или
Подставляя это выражение в выражение полного дифференциала энергии Гиббса, получим
В изотермических условиях (T = const)
Для идеального газа, как следует из уравнения Менделеева-Клапейрона,
тогда
Проинтегрируем полученное выражение:
при T = const и n = const получим:
или
где G 0 – стандартное значение энергии Гиббса при стандартном давлении; Продифференцируем полученное уравнение по числу молей n и при условии, что P = const:
где Таким образом, химический потенциал – это частная производная энергии Гиббса по числу молей вещества при условии, что давление и температура постоянны. Для идеального газа он равен:
При выводе этого уравнения использовалось уравнение Менделеева-Клапейрона, которое справедливо только для идеальных газов. Для реальных газов уравнение состояния в общем случае неизвестно, Поэтому Льюисом был предложен следующий формальный подход: записывать уравнение для химического потенциала реального газа в том же виде, что и для идеального, но использовать не давление, а некую функцию, прямо пропорциональную давлению, f = γ P, которую называют фугитивностью или летучестью. Коэффициент пропорциональности γ (коэффициент фугитивности) характеризует отклонение газа от идеального, он определяется из экспериментальных данных. С использованием фугитивности химический потенциал реального газа можно записать:
где f 0 - стандартная фугитивности, она принимается равной стандартному давлению P 0; отношение Введение понятия химического потенциала позволяет получит чрезвычайно важные уравнения для описания равновесия в термодинамической системе.
2. 3. 5. Уравнение изотермы химической реакции Рассмотрим химическую реакцию
протекающую при P = const и T = const в газовой фазе. Химический потенциал каждого газообразного вещества в реакционной смеси может быть записан как частная производная энергии Гиббса по числу молей данного вещества:
Если в систему добавляется бесконечно малые количества разных газов (dn 1, dn 2 … dnk) при постоянном давлении и постоянной температуре, то суммарное изменение энергии Гиббса буден равно:
Изменение энергии Гиббса при изменении конечного числа молей веществ в газообразной смеси за счет протекания химической реакции можно записать как
где Δ ni – изменение числа молей i- го вещества в ходе химической реакции.
аналогично
Для данной химической реакции изменение энергии Гиббса
а для каждого участника реакции
Тогда
В общем виде для любой реакции
Полученное уравнение называется уравнением изотермы химической реакции. Здесь Δ rG 0 - стандартное изменение энергии Гиббса – не зависит от состава системы, так как в него входят стандартные химические потенциалы.
|

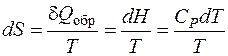
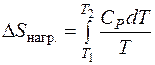
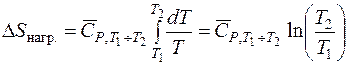
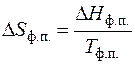
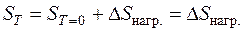
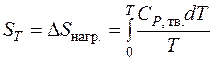 ,
,
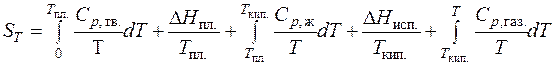
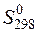 ), значения которых приведены в справочниках.
), значения которых приведены в справочниках.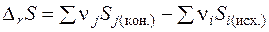
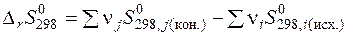
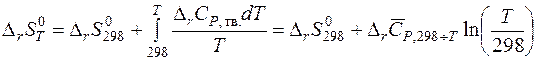
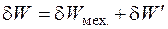
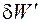 - так называемая, полезная работа; δ W Mex = РdV - механическая работа расширения (сжатия) газа.
- так называемая, полезная работа; δ W Mex = РdV - механическая работа расширения (сжатия) газа.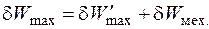
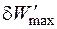 - максимальная полезная работа.
- максимальная полезная работа.
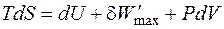
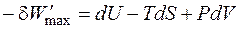
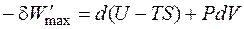
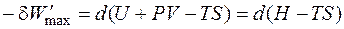
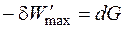
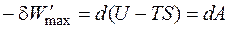
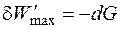
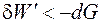 ,
,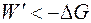
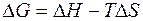 ,
,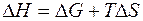
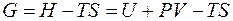 :
: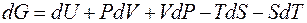
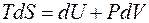
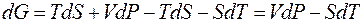
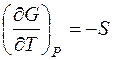
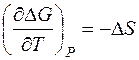
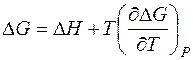
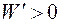 и, следовательно,
и, следовательно, 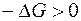 . Отсюда вытекает очень важное соотношение, которое является критерием возможности самопроизвольного протекания процесса в закрытой системе в изобарно-изотермических условиях:
. Отсюда вытекает очень важное соотношение, которое является критерием возможности самопроизвольного протекания процесса в закрытой системе в изобарно-изотермических условиях: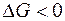 (при P = const и T = const)
(при P = const и T = const) (при V = const и T = const)
(при V = const и T = const)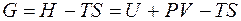 ,
,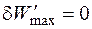 , то из объединенного уравнения первого и второго начала термодинамики следует, что
, то из объединенного уравнения первого и второго начала термодинамики следует, что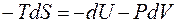
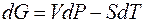
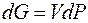
 ,
,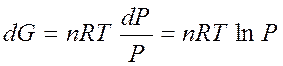
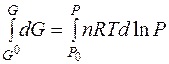
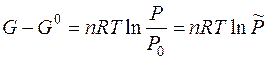
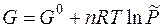 ,
,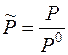 - приведенное давление.
- приведенное давление.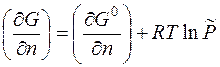
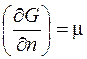 - химический потенциал; а
- химический потенциал; а 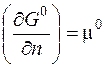 - стандартный химический потенциал.
- стандартный химический потенциал.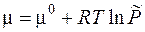
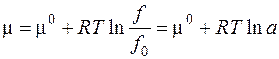 ,
,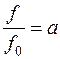 называется активностью газа.
называется активностью газа.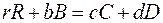 ,
,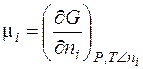
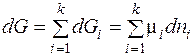
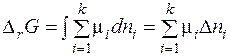 ,
,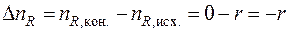 ,
,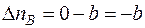
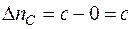
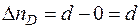
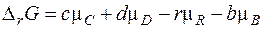 ,
,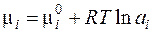
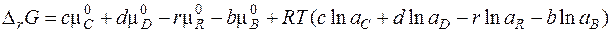 или
или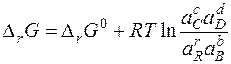
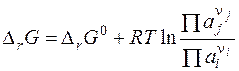 .
.


