Если на систему, находящуюся в равновесии, оказать воздействие извне, то равновесие смещается в сторону того процесса, протекание которого уменьшает оказываемое воздействие
Количественно состояние равновесия характеризуется константой равновесия, поэтому рассмотрим влияние различных факторов на константу равновесия и равновесный выход продуктов.
3. 3. 1. Зависимость константы равновесия от температуры. Уравнения изобары химической реакции. Из сопоставления частного уравнения изотермы химической реакции
и уравнения Гиббса-Гельмгольца
следует, что
После приведения подобных членов получим уравнение изобары химической реакции:
Из дифференциального уравнения изобары химической реакции следует, что зависимость термодинамической константы равновесия Ka от температуры определяется знаком Δ rH. Проанализируем дифференциальное уравнение изобары. 1. Если тепловой эффект реакции Δ rH > 0 (реакция эндотермическая), то производная 2. Если тепловой эффект реакции Δ rH < 0 (реакция экзотермическая), то производная 3. Если тепловой эффект реакции Δ rH = 0, то производная Анализ уравнения изобары химической реакции показывает полное соответствие с принципом Ле Шателье. Таким образом, уравнение изобары химической реакции является термодинамическим обоснованием принципа Ле Шателье.
3. 3. 2. Влияние давления на равновесный выход продуктов химической реакции. Влияние давления на химическое равновесие проанализируем с помощью полученного в разд. 3. 1. уравнения
Как было показано ранее, термодинамическая константа равновесия от давления не зависит, следовательно, при P ≤ 50 атм
Из уравнения видно, что зависимость практической константы равновесия Kn, а, следовательно, и равновесного выхода продуктов, определяется знаком 1. Если 2. Если 3. Если
|







 > 0, и функция
> 0, и функция  возрастающая. Следовательно, термодинамическая константа равновесия Ka с ростом температуры увеличивается, и равновесный выход продуктов растет.
возрастающая. Следовательно, термодинамическая константа равновесия Ka с ростом температуры увеличивается, и равновесный выход продуктов растет.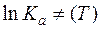 . Следовательно, термодинамическая константа равновесия Ka не зависит от температуры. Этот случай практически не наблюдается.
. Следовательно, термодинамическая константа равновесия Ka не зависит от температуры. Этот случай практически не наблюдается.
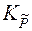 = Ka ≠ f (P). От давления зависит практическая константа равновесия Kn. Эту зависимость удобно анализировать, переписав уравнение в виде:
= Ka ≠ f (P). От давления зависит практическая константа равновесия Kn. Эту зависимость удобно анализировать, переписав уравнение в виде:
 . Проанализируем эту зависимость.
. Проанализируем эту зависимость. , то с увеличением общего давления в системе практическая константа равновесия Kn уменьшится и равновесный выход продуктов реакции упадет.
, то с увеличением общего давления в системе практическая константа равновесия Kn уменьшится и равновесный выход продуктов реакции упадет. , то с увеличением общего давления в системе практическая константа равновесия Kn увеличится и равновесный выход продуктов реакции возрастет.
, то с увеличением общего давления в системе практическая константа равновесия Kn увеличится и равновесный выход продуктов реакции возрастет. , то с увеличением общего давления в системе практическая константа равновесия Kn не изменится, следовательно, давление в этом случае не влияет на равновесный выход продуктов реакции.
, то с увеличением общего давления в системе практическая константа равновесия Kn не изменится, следовательно, давление в этом случае не влияет на равновесный выход продуктов реакции.


