Двухкомпонентные системы
В отличие от однокомпонентной системы уравнение состояния двухкомпонентной системы должно связывать четыре параметра: давление, температуру, объем и состав. Для графического изображения состояния двухкомпонентной системы понадобилась бы четырехмерная фигура. Однако, даже трехмерные диаграммы P – V – состав, P – T – состав, V – T – состав используют довольно редко из-за трудности их воспроизведения. Двухкомпонентные системы исследуют чаще всего в изобарных или изотермических условиях. Двухмерная диаграмма состояния системы при этом может быть построена на плоскости. Наибольшее практическое значение имеют диаграммы температура – состав при постоянном давлении.
4. 6. 1. Бинарные системы взаимно растворимых жидкостей. 4. 6. 1. 1. Общая характеристика растворов Фазы двухкомпонентных систем могут содержать только один из компонентов (индивидуальное вещество) ли быть смешенными, состоящими из двух компонентов. Гомогенные системы переменного состава, состоящие из двух или более компонентов, называют растворами. Свойства растворов являются сложной функцией состава, температуры и давления и определяются характером межмолекулярных взаимодействий. При этом решающую роль играет соотношение энергии взаимодействия между однородными и разнородными частицами. Здесь и далее для обозначения компонентов раствора используются цифровые индексы. Наиболее простые свойства характерны для идеальных растворов. Они получаются из веществ с одинаковыми (или почти одинаковыми) размерами молекул и энергиями междучастичных взаимодействий ε. При смешении таких веществ условия существования молекул каждого компонента практически не изменятся: ε 1-1≈ ε 2-2 ≈ ε 1-2. Поэтому смешение не будет сопровождаться тепловым эффектом (Δ H р-я = 0), а объем раствора равен сумме объемов компонентов (V р-ра = V 1 + V 2). Здесь и далее для обозначения компонентов раствора используются цифровые индексы. Свойства идеальных растворов подчиняются закону Рауля:
где pi – давление насыщенного пара компонента i над раствором; p 0, i – давление насыщенного пара над чистымкомпонентом i; Среди реально существующих растворов достаточно много практически подчиняющихся идеальным законам. Таковы растворы химически подобных веществ, близких членов гомологических рядов и т. п. В качестве примера можно назвать системы бензол – толуол, метанол – этанол, о -ксилол – п -ксилол, гексан – гептан и многие другие. Если энергии взаимодействия между однородными и разнородными частицами не в растворе одинаковы, то закон Рауля не выполняется, и такие растворы называются неидеальными. Для неидеальных растворов: Δ H р-я ≠ 0 и V р-ра ≠ V 1 + V 2. Возможны два вида отклонений от идеального поведения растворов. Положительные отклонения наблюдаются при условии, что однородные молекулы взаимодействуют сильнее, чем разнородные: ε 1-1 и ε 2-2 > ε 1-2. Смешение таких жидкостей сопровождается поглощением тепла (Δ H р-я > 0) и увеличением объема (V р-ра > V 1 + V 2), что свидетельствует об ослаблении общего между молекулярного взаимодействия (разрываются водородные связи между одинаковыми молекулами, разрушаются ассоциаты из однотипных молекул и т. п. В результате облегчается переход молекул из жидкого в парообразное состояние, и давление пара оказывается больше, чем над идеальными растворами. Примерами таких систем являются растворы кислород – азот, этанол – диэтиловый эфир, бензол – ацетон и др. Отрицательные отклонения от идеального доведения характерны для растворов, компоненты которых взаимодействуют друг с другом сильнее, чем однородные молекулы, т. е. ε 1-1 и ε 2-2 < ε 1-2. При образовании таких растворов общее междучастичное взаимодействие усиливается (происходит сольватация, возникают водородные связи, а иногда – химические соединения из разнородных молекул). При этом выделяется теплота (Δ H р-я < 0) и уменьшается объем (V р-ра > V 1 + V 2). Выход молекул из жидкости в пар затрудняется, и давление пара понижается по сравнению с идеальным раствором. Отрицательные отклонения от закона Рауля наблюдаются в системах хлороформ – диэтиловый эфир, хлороформ – бензол, четыреххлористый углерод – диэтиловый эфир и др.
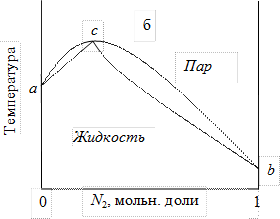
4. 6. 1. 2. Диаграмма состояния температура кипения – состав для идеального жидкого раствора На рисунке 6 приведена диаграмма температура кипения – состав (T – N)при постоянном давлении (диаграмма перегонки) для двух жидкостей, образующих идеальный раствор. Точки a и b на рис.6 показывают температуры кипения чистых компонентов: T 1 = T 0, 2 – температура кипения чистого компонента 1 (точка b); T 4 = T 0, 1 – температура кипения чистого компонента 2 (точка a). Нижняя кривая на рис. 6 – линия aceb – изображает зависимость температуры начала кипения от состава раствора. Ее называют линией кипения или линией испарения. Верхняя кривая adfb показывает температуру конца кипения, т. е. температуру, при которой вся жидкость превратится в пар. Эта же линия показывает температуру начала конденсации пара, если насыщенный пар охлаждать состав пара при постоянном давлении. Ее называют линией конденсации.
Ниже кривой aceb лежит область устойчивого существования одной жидкой фазы, выше кривой adfb – область устойчивогосуществования пара. Между кривыми aceb и adfb наблюдается такое сочетание температур и составов, при котором неустойчивая однофазная система распадается на две термодинамически устойчивые фазы – взаимно насыщенные раствор и пар. В этой области состав жидкости показывает линия aceb. Верхняя кривая adfb показывает состав пара, находящегося в равновесии с жидкостью. Например, при температуре T 2 точка e показывает состав жидкой фазы (точка e’ на оси абсцисс), а точка f показывает состав паровой фазы (точка f’ на оси абсцисс). При температуре T 3 точка c показывает состав жидкой фазы (точка c’ на оси абсцисс), а точка d показывает состав паровой фазы (точка d’ на оси абсцисс). Таким образом, из диаграммы состояния двухкомпонентной системы следует, что состав жидкости не совпадает с составом равновесного с нею пара. Из рисунка 6 видно, что пар по сравнению с жидкостью обогащен компонентом 2, температура кипения которого ниже. Эта закономерность была сформулирована как первый закон Коновалова-Гиббса: В равновесной системе пар по сравнению с жидкостью обогащен тем компонентом, добавление которого понижает температуру кипения раствора при заданном давлении или повышает общее давление пара. Компонент, имеющий более низкую температуру кипения, является более летучим. Кипение (образование пузырей в толще жидкости) происходит тогда, когда давление насыщенного пара над жидкостью становится равным внешнему давлению, и испарение с поверхности жидкости становится невозможным. Поэтому, чем больше давление насыщенного пара компонента, т. е. чем более летучий компонент, тем при более низкой температуре достигается равенство давления насыщенного пара и внешнего давления. Первый закон Коновалова-Гиббса имеет большое значение в процессах разделения жидкостей методами перегонки и ректификации Применение правила фаз, показывает, что в области существования одной фазы (жидкой или парообразной) число степеней свободы равно:
т. е. одновременно и произвольно можно менять и температуру, исостав системы. Для двухфазной системы
и произвольно можно менять либотемпературу, либосостав одной из фаз.
4. 6. 1. 3. Правило рычага При анализе диаграммы T – N (рис.6 и 7) было показано, что область, лежащая между линиями кипения и конденсации, соответствует такому сочетанию параметров, при котором однородная система распадается на две фазы. Точка k на рис. 7, определяющая некоторую температуру и состав системы в целом (такие точки называют фигуративными или изобразительными точками системы), отвечает именно такой системе. Точки c и d обозначают составы равновесных взаимнонасыщенных фаз, сопряженных фаз. Отрезки прямых, связывающих сопряженные составы, называют нодами. Для двухкомпонентных систем ноды всегда параллельны оси составов, так как непременным условием равновесия является равенство температур и давлении. Диаграммы Т – N дают возможность оценить не только составысоответствующих фаз, но и их относительные количества. Для этой цели используют так называемое правило рычага, которое можно записать в форме уравнения (см. рис. 7):
Если состав раствора выражен не молярными долями, а массовыми (или массовыми процентами), то и количества фаз следует выражать в единицах массы:
Чтобы найти абсолютные количества надо использовать еще одно соображение: при кипении общее количество веществ в системе остается постоянным, происходит лишь перераспределение веществ между фазами. Таким образом, чтобы определить массу жидкой и паровой фазы при любой температуре надо решить система уравнений:
Использование правила рычага не ограничивается упомянутым соотношением количеств жидкости и пара. Оно применимо к любым двухфазным равновесным системам.
4. 6. 1. 4. Диаграммы температура кипения – состав для неидеальных растворов Давая общую характеристику растворов (разд. 4. 6. 1.), мы отмечали, что идеальные растворы образуются при смешении веществ с практически одинаковыми энергиями междучастичного взаимодействия. Если это не выполняется, растворы не будут подчиняться закону Рауля. Отклонения от закона Рауля – положительные или отрицательные – сказываются на температуре кипения растворов, что соответственно отражается на виде диаграмм перегонки T – N. При положительных отклонениях от закона Рауля давление пара над раствором выше и, следовательно, температура его кипения понижается. При этом линия кипения на диаграмме T – N прогибается вниз (рис. 8а). При отрицательных отклонениях от закона Рауля давление пара над раствором ниже и, следовательно, температура его кипения повышается. При этом линия кипения на диаграмме T – N прогибается вверх (рис. 8б). При определенных соотношениях между разностью давлений пара чистых компонентов и степенью отклонения от закона Рауля возможно появление экстремумов на диаграммах T – N (рис.9). Примерами систем с минимумом температуры кипения (положительные отклонения от закона Рауля) (рис.9а) являются системы: вода – этанол, хлороформ – метанол, сероуглерод – ацетон и другие. Примерами систем с максимумом температуры кипения (отрицательные отклонения от закона Рауля) (рис. 9б) являются системы: хлороформ – ацетон, вода – кислота (азотная, муравьиная, фтороводородная, хлороводородная, хлорная) и другие.
Рис. 8. Зависимость температуры кипения от состава при постоянном давлении: отрицательные (а) и положительные (б) отклонения от закона Рауля
При близких значениях давления насыщенного пара над чистыми жидкими компонентами (p 0, 1 ≈ p 0, 2) уже малое отклонение от закона Рауля может привести к появлению экстремума. В системах с заметно различающимися p 0, 1 и p 0, 2 для возникновения экстремума необходимы значительные отклонения от закона Рауля. Положение экстремальной точки (точки c на рис.9) тем ближе к N = 0, 5, чем меньше разница между p 0, 1 и p 0, 2. И наоборот, чем больше различие в давлениях пара чистых компонентов, тем заметнее смещение точки экстремума в сторону более летучего компонента при положительных отклонениях от закона Рауля и в сторону менее летучего – при отрицательных. Состав паровой фазы для неидеальных систем определяется, так же, как и для идеальных, по линии конденсации диаграмм перегонки. Однако первый закон Гиббса—Коновалова для систем экстремумом температуры кипения выполняется не всегда. Для таких систем был сформулирован второй закон Коновалова – Гиббса:
|

 ,
,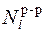 - молярная доля компонента i в растворе. Насыщенным называется пар, находящийся в равновесии с жидкостью, т.е. в стоянии, когда скорость испарения равна скорости конденсации.
- молярная доля компонента i в растворе. Насыщенным называется пар, находящийся в равновесии с жидкостью, т.е. в стоянии, когда скорость испарения равна скорости конденсации.

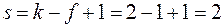

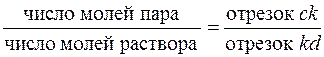 ,
,