Тогда уравнение примет вид
Эта формула называется основным уравнением молекулярно-кинетической теории идеальных газов. Учитывая, что n = N/V, получим
или
где E - суммарная кинетическая энергия поступательного движения всех молекул газа. Так как масса газа m = Nm o, то уравнение можно переписать в виде
Для одного моля газа т = М (М - молярная масса), поэтому
где VM - молярный объем. С другой стороны, по уравнению Клапейрона-Менделеева, pVM=RT. Таким образом, откуда
Так как M = m о NA, где m о - масса одной молекулы, а N А - постоянная Авогадро, то из уравнения следует, что
где k = R / N A - постоянная Больцмана. Отсюда найдем, что при комнатной температуре молекулы кислорода имеют среднюю квадратичную скорость 480 м / с, водорода - 1900 м / с. При температуре жидкого гелия те же скорости будут соответственно 40 м / с и 160 м / с. Средняя кинетическая энергия поступательного движения одной молекулы идеального газа Из этого уравнения следует, что при Е =0 Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа и полученная формула раскрывает молекулярно-кинетическое толкование температуры. Полученная формула раскрывает молекулярно-кинетическое толкование температуры. РЕЗЮМЕ - Основне рівняння молекулярно-кінетичної теорії ідеального газу пов'язує термодинамічні параметри, що характеризують систему частинок як одне ціле з середніми характеристиками руху окремих частинок (швидкістю руху) - Середня кінетична енергія поступального руху однієї молекули ідеального газу пропорційна термодинамічної температурі і залежить тільки від неї. - Термодинамічна температура є мірою середньої кінетичної енергії поступального руху часток ідеального газу Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул Важной характеристикой термодинамической системы является ее внутренняя энергия U - энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис.77, б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i =5). Трехатомная (рис.77, в) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения. Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул:для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT /2, а на каждую колебательную степень свободы - в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
где i - сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы: i=i поступ +i вращ + 2 i колеб. В классической теории рассматривают молекулы с жёсткой связью между атомами; для них i совпадает с числом степеней свободы молекулы. Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий N А молекул:
Внутренняя энергия для произвольной массы т газа
где М - молярная масса, n - количество вещества.
|

 .
.




 .
. ,
, пропорциональна термодинамической температуре и зависит только от нее.
пропорциональна термодинамической температуре и зависит только от нее. , т.е. при 0 К прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю.
, т.е. при 0 К прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Внутренняя энергия - однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода. Ранее было введено понятие числа степеней свободы — числа независимых переменных (координат), полностью определяющих положение системы в пространстве. В ряде задач молекулу одноатомного газа (рис.77, а) рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать (
Внутренняя энергия - однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода. Ранее было введено понятие числа степеней свободы — числа независимых переменных (координат), полностью определяющих положение системы в пространстве. В ряде задач молекулу одноатомного газа (рис.77, а) рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать ( ,
,  ,
,  ).
). значения <eo> в
значения <eo> в  .
.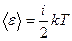 ,
, .
. ,
,


