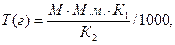Формулы расчета, необходимые для проведения титриметрических методов анализа
Результаты анализа существенно зависят от точности концентрации титрованного раствора.
Изготовление титрованных растворов может осуществляться на договорных условиях в контрольно-аналитической лаборатории. Государственная фармакопея Украины рекомендует готовить титрованные растворы в соответствии с обычными требованиями химического анализа.
В ГФУ концентрацию титрованных растворов выражают с помощью молярности.
Под молярной концентрацией (М) понимают количество молей вещества, растворенного в 1л раствора. Молярность рассчитывают как отношение количества растворенного вещества к объему (размерность – моль/л).
Титр – выраженная в граммах масса растворенного вещества, находящаяся в 1 мл раствора. Титр рассчитывают, как отношение массы растворенного вещества к объему (размерность – г/мл или мг/мл).
Титр титранта по определяемому веществу выраженный в граммах или миллиграммах – это количество определяемого вещества, которое взаимодействует с 1 мл титрованного раствора.
Титрованные растворы готовят из химически чистых веществ, чистых для анализа или путем растворения фиксаналов (точного количества вещества, находящегося в запаянной ампуле), в определенном объеме свежепрокипяченной и охлажденной дистиллированной воды или другого растворителя.
При приготовлении титрованных растворов из исходных веществ концентрация полученного раствора может отличаться от требуемой. В этом случае рассчитывают коэффициент поправки к молярности.
Коэффициент (К) показывает во сколько раз концентрация приготовленного раствора отличается от теоретической. Допускается коэффициент поправки в пределах от 0,9 до 1,1 (ГФУ требует – не более 10% от теоретической).
Более разбавленные растворы получают разведением титрованных растворов водой, свободной от оксида углерода. При этом поправочные коэффициенты полученных растворов остаются такими же как и у исходных. Данные растворы готовят непосредственно перед употреблением.
Титрованные растворы хранят при комнатной температуре, защищая их при необходимости от воздействия углекислоты, влаги воздуха и от прямых солнечных лучей.
Согласно требованиям Государственной фармакопеи, титрованные растворы имеют ограниченный срок годности. Провизор-аналитик должен следить за их качеством и своевременно обновлять титрованные растворы.
Титр определяемого вещества рассчитывают по формуле:
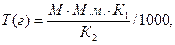
где: М – молярность титрованного раствора, моль/л;
М.м. – молярная масса определяемого вещества, г/моль;
К1 – коэффициент при определяемом веществе в уравнении химической реакции определения количественного содержания
К2 – коэффициент при титранте в уравнении химической реакции определения количественного содержания
Перечень титрованных растворов приведенных в ГФУ с указанием их концентрации
| №
п/п
| Название титрованного раствора по ГФУ (ГФ X)
| Концентрация титрованного раствора согласно ГФУ
| Концентрация титрованного раствора согласно ГФХ
| | 1.
| Раствор аммония тиоцианата (раствор аммония роданида)
| 0,1М
| 0,1 н
| | 2.
| Раствор аммония церия нитрата
| 0,1 М
0,01 М
|
| | 3.
| Раствор аммония церия сульфата
| 0,1 М
0,01 М
|
| | 4.
| Раствор бария перхлората
| 0,05 М
0,025
|
| | 5.
| Раствор бария хлорида
| 0,1 М
|
| | 6.
| Раствор бензэтония хлорида
| 0,004 М
|
| | 7.
| Раствор бромид-бромата
| 0,0167 М
|
| | 8.
| Раствор железа аммония сульфата
| 0,1 М
|
| | 9.
| Раствор железа сульфата
| 0,1 М
|
| | 10.
| Раствор йода
| 0,5М
0,05М
0,01М
| 1 н
0,1 н
0,02 н
| | 11.
| Раствор йодмонохлорида (раствор хлористого йода)*
| 0,05М
| 0,1н
| | 12.
| Раствор калия бромата
| 0,033 М
0,02 М
0,0167 М
0,083 М
|
0,1н
| | 13.
| Раствор калия гидроксида
| 1М
0,1М
|
0,01 н
| | 14.
| Раствор калия гидроксида в спирте (60%, об/об).
| 0,5М
|
| | 15.
| Раствор калия гидроксида спиртовой (раствор кали едкого спиртовой)
| 0,5М
0,1М
0,01М
| 0,5н
0,1н
| | 16.
| Раствор калия гидрофталата
| 0,1М
|
| | 17.
| Раствор калия дихромата (раствор бихромата калия)
| 0,0167М
| 0,1н
| | 18.
| Раствор калия йодата (раствор йодата калия)
| 0,05М
0,0167М
|
0,1н
| | 19.
| Раствор калия йодида
| 0,001М
|
| | 20.
| Раствор калия перманганата (раствор перманганата калия)
| 0,02М
| 1н
| | 21.
| Раствор кислоты азотной
| 1 М
|
| | 22.
| Раствор кислоты серной
| 0,5М
0,05М
| 1н
0,01н
| | 23.
| Раствор кислоты уксусной
| 0,1М
|
| | 24.
| Раствор кислоты хлористоводородной (раствор соляной кислоты)
| 6М
3М
2М
1М
0,1М
| 6н
1н
0,1 н
| | 25.
| Раствор кислоты хлористоводородной в спирте
| 0,1М
|
| | 26.
| Раствор кислоты хлорной
| 0,1М
0,05М
| 0,1н
0,05н
| | 27.
| Раствор лития метилата
| 0,1М
|
| | 28.
| Раствор магния хлорида
| 0,1М
|
| | 29.
| Раствор меди сульфата (раствор сульфата меди)
| 0,02М
| 0,02н
| | 30.
| Раствор натрия арсенита
| 0,1М
|
| | 31.
| Раствор натрия гидроксида (раствор едкого натра)
| 1М
0,1М
| 1н
0,1н
| | 32.
| Раствор натрия гидроксида этанольный
| 0,1М
|
| | 33.
| Раствор натрия метилата
| 0,1М
| 0,1н
| | 34.
| Раствор натрия нитрита (раствор нитрита натрия)
| 0,1М
| 0,1н
| | 35.
| Раствор натрия перйодата
| 0,1М
|
| | 36.
| Раствор натрия тиосульфата (раствор тиосульфата натрия)
| 0,1М
| 0,1н
| | 37.
| Раствор натрия эдетата (раствор трилона Б)
| 0,1М
0,05М
0,02М
| 0,2н
0,1н
0,04н
| | 38.
| Раствор ртути нитрата (раствор нитрата ртути)
| 0,05М
0,02М
| 0,1н
0,04н
| | 39.
| Раствор свинца нитрата
| 0,1М
|
| | 40.
| Раствор серебра нитрата (раствор нитрата серебра)
| 0,1М
0,001М
| 0,1н
| | 41.
| Раствор тетрабутиламмония гидроксид
| 0,1М
|
| | 42.
| Раствор тетрабутиламмония гидроксид в 2-пропаноле
| 0,1М
|
| | 43. Р
| Раствор церия сульфата
| 0,1М
| 0,1н
| | 44.
| Раствор цинка сульфата (раствор сульфата цинка)
| 0,1М
|
| | 45.
| Раствор цинка хлорида
| 0,05М
|
| | 46.
| Щелочной раствор меди этилендиамина
| 1М
|
| * - раствор не приведен в ГФУ
** - раствор не приведен в ГФХI

Практические расчеты на срез и смятие При изучении темы обратите внимание на основные расчетные предпосылки и условности расчета...
|

Функция спроса населения на данный товар Функция спроса населения на данный товар: Qd=7-Р. Функция предложения: Qs= -5+2Р,где...
|

Аальтернативная стоимость. Кривая производственных возможностей В экономике Буридании есть 100 ед. труда с производительностью 4 м ткани или 2 кг мяса...
|

Вычисление основной дактилоскопической формулы Вычислением основной дактоформулы обычно занимается следователь. Для этого все десять пальцев разбиваются на пять пар...
|
Седалищно-прямокишечная ямка Седалищно-прямокишечная (анальная) ямка, fossa ischiorectalis (ischioanalis) – это парное углубление в области промежности, находящееся по бокам от конечного отдела прямой кишки и седалищных бугров, заполненное жировой клетчаткой, сосудами, нервами и...
Основные структурные физиотерапевтические подразделения Физиотерапевтическое подразделение является одним из структурных подразделений лечебно-профилактического учреждения, которое предназначено для оказания физиотерапевтической помощи...
Почему важны муниципальные выборы? Туристическая фирма оставляет за собой право, в случае причин непреодолимого характера, вносить некоторые изменения в программу тура без уменьшения общего объема и качества услуг, в том числе предоставлять замену отеля на равнозначный...
|
Предпосылки, условия и движущие силы психического развития Предпосылки –это факторы. Факторы психического развития –это ведущие детерминанты развития чел. К ним относят: среду...
Анализ микросреды предприятия Анализ микросреды направлен на анализ состояния тех составляющих внешней среды, с которыми предприятие находится в непосредственном взаимодействии...
Типы конфликтных личностей (Дж. Скотт) Дж. Г. Скотт опирается на типологию Р. М. Брансом, но дополняет её. Они убеждены в своей абсолютной правоте и хотят, чтобы...
|
|