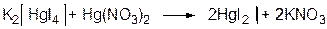Меркуриметрическое определение.
При добавлении сильно ионизированной соли окисной ртути (например, нитрата ртути) к испытываемому раствору хлорида из раствора исчезают ионы Cl- вследствие образования малодиссоциированного галогенида ртути. Малейший избыток ионов ртути реагирует с индикатором дифенилкарбазидом, с образованием окрашенного в красно-фиолетовый цвет соединения. 2NaCl (NaBr) + Hg(NO3)2 → HgCl2 (HgBr2) + 2NaNO3
Точку эквивалентности можно установить с помощью нитропруссида натрия:(титруют до образования мути) требуется вводить поправку на индикатор. Na2[Fe(CN)5NO] + Hg(NO3)2 → Hg[Fe(CN)5NO]↓ + 2NaNO3 Примечание: Для улучшения условий титрования можно к водному раствору хлорида или бромида прибавить несколько миллилитров 95% этилового спирта. Меркуриметрическое определение йодидов. Точную массу калия или натрия йодида растворяют в минимальном объеме воды и титруют без индикатора раствором нитрата окисной ртути до появления не исчезающей розовой мути:
Избыточная капля нитрата окисной ртути реагирует с комплексом K2HgI4 c выделением осадка дийодида ртути, который и наблюдается в конце титрования:
Перманганатометрическое определение йодидов. Около 0,05 г калия или натрия йодида растворяют в 5 мл воды, прибавляют 5 мл кислоты хлористоводородной 1:1 (приблизительно 18%) и титруют 0,02М. раствором калия перманганата до появления светло-бурой окраски раствора, затем прибавляют 1 мл раствора крахмала и продолжают титрование по каплям до перехода окраски в лимонно-желтую: 2KMnO4 + 5KI + 16HCl → 5IСl + 7KCl + 2MnCl2 + 8H2O IСl + HCl → H[ICl2].
|