Применение серы и ее соединений в медицине
1) Очищенная мелкодисперсная сера применяется наружно в 15-20% мазях и присыпках при лечении псориаза, себореи, чесотки и внутрь в качестве слабительного и отхаркивающего средства. Она взаимодействует с органическими веществами, образуя сульфиды и пентатионовую кислоту, которые оказывают противомикробное и противопаразитарное действие. 2) Радиоактивная сера и меченные ею соединения используются в экспериментальной медицине в качестве индикаторов. 3) Сероводородные (H2S) ванны благоприятно влияют на организм при различных заболеваниях. 4) Большое распространение получили производные моноамида серной кислоты – сульфаниламидные препараты: стрептоцид, норсульфазол, сульфадиметаксин, сульфамонометоксин, фталазол и др., обладающие антибактериальной активностью. 5) Пентагидрат тиосульфата натрия Na2S2O3×5H2O применяется, как противоядие при отравлениях цианидами, синильной кислотой, солями тяжелых металлов, иодом. 6) Тиосульфат натрия Na2S2O3 в виде 30% раствора применяется как антисептическое средство при аллергических заболеваниях, артритах, невралгиях, красной волчанке. Наружно тиосульфатом лечат чесотку, грибковые заболевания. При подкислении водных растворов тиосульфата образуются сера и оксид серы(IV) Na2S2O3 + 2HCl = 2NaCl + SO2 + S + H2O Эта реакция лежит в основе метода лечения чесотки по Демьяновичу: сначала в кожу втирается раствор Na2S2O3, а затем раствор HCl. Образующиеся при этом продукты реакции (SO2 и S) оказывают противопаразитарное действие. Na2S2O3 используется при отравлении цианидами, т.к. окисляет цианид-анион в значительно менее ядовитый тиоцианат-анион: KCN + Na2S2O3 ® Na2SO3 + KNCS Со многими ионами-токсикантами: кадмия, меди(I), ртути(II), свинца(II), серебра – тиосульфат-анион образует прочные комплексы и малорастворимые нетоксичные соединения, поэтому он используется как универсальный антидот: Hg2+ + 4S2O Pb2+ + S2O 7) Серная кислота H2SO4 применяется как противоядие при отравлениях солями бария и свинца, для подкисления микстур. Определение сульфатов в моче позволяет судить о процессах гниения белков в кишечнике. Концентрированная серная кислота оказывает прижигающее действие путем дегидратации поверхностных элементов с образованием плотного струпа (коагуляционный некроз). 8)
9) Унитиол и сукцимер
называют антидотами. Они используются при отравлениях мышьяком, ртутью, кадмием, свинцом, хромом, кобальтом и некоторыми радиоактивными элементами, т.к. являясь мягкими основаниями, связывают мягкие кислоты – ионы токсичных металлов, согласно принципу ЖМКО, в прочные комплексные соединения, которые затем выводятся с мочой из организма, например:
Издавна использовалась сера в медицине – ее пламенем окуривали больных, ее включали в состав различных мазей для лечения кожных заболеваний. Все сульфамидные препараты – сульфидин, норсульфазол, сульфадимезин, стрептоцид и другие подавляют активность многочисленных микробов. Все эти лекарства – органические соединения серы. Многие антибиотики можно рассматривать как органические производные серы, в частности, сера входит в состав пенициллина. Мелкодисперсная элементарная сера – основа мазей, применяемых при лечении заболеваний кожи.
Азот
Азот открыт в 1772 шотландским ученым Д. Резерфордом в составе продуктов сжигания угля, серы и фосфора как газ, непригодный для дыхания и горения («удушливый воздух») и в отличие от CO2 не поглощаемый раствором щелочи. Вскоре французский химик А. Л. Лавуазье пришел к выводу, что «удушливый» газ входит в состав атмосферного воздуха, и предложил для него название «azote» (от греч. azoos — безжизненный). В 1784 английский физик и химик Г. Кавендиш установил присутствие азота в селитре (отсюда латинское название азота, предложенное в 1790 французским химиком Ж. Шанталем).
Электронная конфигурация атома: 1 s 2 2 s 22 p 3. Электронное строение атома азота позволяет ему образовывать три ковалентные связи по обменному механизму за счет трех неспаренных электронов (2 p 3) и связь по донорно-акцепторному механизму за счет донорной пары (2 s 2) электронов. Характерные степени окисления атома азота: со –3 –2 –1 +1 +2 +3 +4 +5 NH3, N2H4, NH2OH, N2O, NO, N2O3, NO2, N2O5 В метаболитах атомы азота связаны с атомами водорода, углерода и имеют степень окисления –3. Азот является обязательной составной частью белка (15-17,6%), витаминов, гормонов и других биологически активных соединений. Для атома азота характерна высокая электроотрицательность (ЭО = 3,1), поэтому азотсодержащие связи полярны. Азот образует довольно прочные ковалентные связи, способные под влиянием ферментов легко разрываться, создавая условия для биохимических реакций. Жизненно важными соединениями являются a-аминокислоты – структурные единицы белков. Между атомами азота в молекуле образуется тройная связь NºN. Прочность связи очень высокая, реакционная способность вследствие этого низкая. Азот не горит и не поддерживает горения других веществ, напротив, он является конечным продуктом окисления других азотсодержащих веществ. Азот – газ без цвета и запаха, плохо растворим в воде и органических растворителях. Содержание в воздухе – 78 об%. Азот хорошо растворяется в биологических жидкостях. Избыток его в крови в условиях повышенного давления может быть причиной развития кессонной болезни (водолазы, космонавты). Последовательные стадии утилизации атмосферного азота связаны с деятельностью нитрифицирующих бактерий и состоят в следующем: N2
|

 ® [Hg(S2O3)4]6–;
® [Hg(S2O3)4]6–;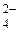 + 2H+.
+ 2H+. В медицине широкое применение нашли различные сульфаты: Na2SO4×10H2O – глауберова соль, CaSO4×2H2O – гипс, 2CaSO4×H2O –алебастр, MgSO4×7H2O, BaSO4, CuSO4, ZnSO4, FeSO4×7Н2О – железный купорос, KАl(SO4)2×12H2О –алюмокалиевые квасцы.
В медицине широкое применение нашли различные сульфаты: Na2SO4×10H2O – глауберова соль, CaSO4×2H2O – гипс, 2CaSO4×H2O –алебастр, MgSO4×7H2O, BaSO4, CuSO4, ZnSO4, FeSO4×7Н2О – железный купорос, KАl(SO4)2×12H2О –алюмокалиевые квасцы.

 …Если в лаборатории разлили ртуть (возникла опасность отравления ртутными парами!), её первым делом собирают, а те места, из которых серебристые капли не извлекаются, засыпают порошкообразной серой. Ртуть и сера вступают в реакцию даже в твёрдом состоянии – при простом соприкосновении. Образуется кирпично-красная киноварь – сульфид ртути – химически крайне инертное и безвредное вещество.
…Если в лаборатории разлили ртуть (возникла опасность отравления ртутными парами!), её первым делом собирают, а те места, из которых серебристые капли не извлекаются, засыпают порошкообразной серой. Ртуть и сера вступают в реакцию даже в твёрдом состоянии – при простом соприкосновении. Образуется кирпично-красная киноварь – сульфид ртути – химически крайне инертное и безвредное вещество. Азот, N, в ПСЭ находится во 2-ом периоде, V-A группе.
Азот, N, в ПСЭ находится во 2-ом периоде, V-A группе. NH3
NH3  NO
NO 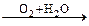 HNO3
HNO3


