Кислородные соединения азота. Оксид азота (I) в смеси с кислородом используется в медицине для ингаляционного наркоза
N2O – оксид азота (I) («веселящий» газ). Бесцветный газ со слабым приятным запахом и сладковатым вкусом. Мало растворяется в воде, не реагирует с ней. Индифферентный оксид. Оксид азота (I) в смеси с кислородом используется в медицине для ингаляционного наркоза. При малых концентрациях он вызывает возбуждение («веселящий» газ), а при больших – общий наркоз. Объясняется это, по-видимому, тем, что в клетках головного мозга молекулы N2O гидратируются за счет «неструктурированной» воды и создают вокруг себя гидратную оболочку из «структурированной» воды, разрушая за счет этого гидратную оболочку мембрановыстилающих белков. Уменьшение гидрофильности белков приводит к их отслаиванию. Появившаяся новая граница раздела нарушает ионную проводимость клеточной мембраны, что, в свою очередь, вызывает потерю чувствительности клеток мозга к нервным импульсам от болевых точек, т.е. анестезию. При прекращении подачи этих веществ они диффундируют из клетки, состояние внутриклеточной водной системы восстанавливается, эффект анестезии исчезает. NO – оксид азота(II) – бесцветный газ, без запаха, мало растворим в воде, токсичен. За два последних десятилетия было установлено, что эта молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO, являясь одним из мессенджеров, участвует в регуляции систем внутри- и межклеточной сигнализации. Оксид азота отвечает за эндотелиальную релаксацию гладких мышц (вазодилатацию), предотвращающую агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в процессах нервной, репродуктивной и иммунной системах. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания как ассенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (т.е. болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др. По сути, монооксид азота является локальным тканевым гормоном. NO играет ключевую роль в подавлении активности бактериальных и опухолевых клеток путем либо блокирования некоторых их железосодержащих ферментов, либо путем повреждения их клеточных структур оксидом азота или свободными радикалами, образующимися из оксида азота. Одновременно, в очаге воспаления накапливается супероксид, который вызывает повреждение белков и липидов клеточных мембран, что и объясняет ее цитотоксическое действие на клетку-мишень. Следовательно, NO, избыточно накапливаясь в клетке, может действовать двояко: с одной стороны вызывать повреждение ДНК и с другой – давать противовоспалительный эффект. Оксид азота способен инициировать ангиогенез (образование кровеносных сосудов). В случае инфаркта миокарда оксид азота играет положительную роль, т.к. индуцирует новый сосудистый рост, но при раковых заболеваниях тот же самый процесс вызывает развитие опухолей, способствуя питанию и росту раковых клеток, но с другой стороны, вследствие этого улучшается доставка оксида азота в опухолевые клетки. В 1998 году трое американцев Фурчготт, Игнарро и Мюрад были удостоены премии Нобелевского комитета по физиологии «за открытия, касающиеся оксида азота(II) как сигнальной молекулы в сердечно-сосудистой системе». Исследователи из университета Северной Каролины (США) нашли способ, как заключить NO в наночастицы диоксида кремния. Наночастицы имеют ряд преимуществ по сравнению с низкомолекулярными источниками NO – прежде всего, большее время высвобождения газообразного оксида азота, который, к тому же, требуется в меньших концентрациях. Ученые показали, что созданные ими наночастицы эффективны для борьбы с синегнойной палочкой in vitro. NO – активный лиганд, образует комплексное соединение с железом гемоглобина, причем в 60 раз более прочное, чем соединение гемоглобина с кислородом, что является причиной токсичности оксида азота(II): HHb + NO ® HHbNO N2O3 – оксид азота(III). Существует в твердом состоянии при температуре ниже –100оС. При других температурах практически не существует, т.к. в жидком и парообразном состояниях в значительной степени диссоциирован за счет диспропорционирования: +3 +2 +4 N2O3 NO + NO2 N2O3 – кислотный оксид, ему соответствует азотистая кислота. HNO2 – азотистая кислота существует только в растворах. HNO2 – амфолит с более сильно выраженной кислотной функцией. В ее водных растворах существуют равновесия: NO+ + OH– HNO2 H+ + NO Кислородные соединения азота (III) нитрит-анионы, являющиеся сильными окислителями, попадая в кровь, вызывают метгемоглобинемию, острое кислородное голодание тканей из-за уменьшения содержания гемоглобина в крови, а также увеличивают свободнорадикальное окисление в организме: HHb(Fe+2) + NO Выделяющийся при этом оксид азота(II) образует устойчивый комплекс с гемоглобином – нитрозогемоглобин: NO + HHb = HHbNO В желудке нитриты образуют азотистую кислоту, которая при взаимодействии со вторичными аминами образует сильные канцерогены – нитрозоамины: R2N–H + HO–N=O = R2N–N=O + H2O По этой причине запрещено добавление токсичных нитритов в качестве консервантов в мясопродукты. NO2 – оксид азота(IV) –красно-бурый ядовитый газ с резким запахом. NO2 – сильный окислитель. В состав встречающихся в промышленности нитрозных газов входят NO, N2O3, NO2, N2O4. При контакте этих газов с влажной поверхностью образуются HNO3 и HNO2, поражающие альвеолярную ткань, что приводит к отеку легких и сложным рефлекторным расстройствам. При отравлении нитрозными газами в крови обнаруживаются нитраты и нитриты, которые действуя на артерии, вызывают расширение сосудов и снижение кровяного давления. попадая в кровь нитраты соединяются с гемоглобином, что приводит к появлению кислородной недостаточности. В последнее время основной угрозой для горожан становится фотохимический смог, который образуется по схеме: NO2 O + O2 + M ® O3 + M* (М* – газообразная молекула в возбужденном состоянии). О3 + NO ® NO2 + O2 Часть озона и кислорода реагирует с УВ, содержащимися в воздухе, по свободнорадикальному механизму, образуя кетоны, альдегиды, пероксиды, которые оказывают раздражающее действие на человеческий организм. Многие промежуточные нитро- и нитрозосоединения являются высокотоксичными веществами, стимулирующими опухолевые процессы. N2O5 – оксид азота(V) – белое кристаллическое вещество. Молекулярную структуру имеет только в газообразном состоянии. В твердом состоянии образован ионами NO Азотная кислота – бесцветная летучая жидкость, сильный окислитель. Она разрушает животные и растительные ткани, окисляет почти все металлы (кроме золота и платины) и неметаллы. Восстановление азотной кислоты зависит от ее концентрации и природы восстановителя: Соли азотной кислоты – нитраты – хорошо растворимы в воде. При нагревании они разлагаются, причем продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов. Нитраты являются в кислых растворах более слабыми окислителями, чем азотная кислота, а в нейтральных растворах вообще не обладают окислительными свойствами. Содержащиеся в некоторых продуктах, в основном фруктах и овощах, нитраты могут в организме восстанавливаться до токсичных нитритов: NO В связи с этим санитарные нормы содержания нитратов в питьевой воде не более 10 мг/л. Более высокое содержание нитратов может привести к заболеванию раком желудка. Соединения азота, применяемые в медицине: 1) Нашатырный спирт (25% раствор NH3) применяется как средство для возбуждения дыхательного центра (первая помощь при угаре, обморочном состоянии, опьянении). Раствор аммиака оказывает антимикробное действие и хорошо очищает кожу. 2) Нашатырь (хлорида аммония (NH4Cl) применяется внутрь при отеках сердечного происхождения, а также как отхаркивающее при бронхитах, пневмониях и т.д. 3) Оксид азота(I) N2O – физиологически активное соединение. Вдыхание малых доз вызывает опьяняющее действие, в больших дозах – потерю болевой чувствительности, благодаря чему находит применение в хирургической практике, как анестезирующее средство в смеси с кислородом (газовый наркоз). 4) Нитрит натрия NaNO2 применяется как сосудорасширяющее средство при стенокардии, а также при отравлении цианидами (внутривенно вводится 5 мл 1%-ного раствора NaNO2). 5) Азотная кислота HNO3 применяется наружно для прижигания и выведения бородавок и мозолей. 6) Органические эфиры: нитроглицерин, нитронол, эринит и др., которые вызывают расширение кровеносных сосудов и понижают артериальное давление. 7) Нитропроизводные фурфурола – фуразолин, фурадонин, фурацилин и др. применяют в медицинской практике как антимикробные средства. «Металлы жизни»
К «металлам жизни» относятся 10 элементов: натрий, калий, магний, кальций, железо, марганец, молибден, медь, кобальт, цинк. Натрий, калий, магний, кальций – важнейшие электролиты организма человека (табл. 6). Таблица 6 Содержание электролитов в клетках и внеклеточной жидкости
Ионы Na+ и К+ распределены по всему организму, в основном, в свободном виде, хотя некоторая их часть связана с белками. Для живых организмов характерна натрий-калиевая ионная ассиметрия. Диффузия гидрофильных частиц – ионов натрия и калия – через гидрофобные мембраны объясняется способностью этих ионов образовывать комплексы с ионофорами, причем ионы калия образовывают более прочные комплексы, чем ионы натрия, поэтому мембраны более проницаемы для ионов калия. Для поддержания более высокой концентрации ионов натрия с внешней стороны, а ионов калия – с внутренней сторны мембраны, необходимо постоянное перемещение этих ионов против градиента концентрации – активный транспорт. Этот процесс является эндэргоническим и сопряжен с гидролизом АТФ. Транспортную функцию выполняет фермент Na+, К+-АТФаза. Гидролиз 1 молекулы АТФ обеспечивает транспорт трех ионов Na+ из клетки и двух ионов калия в клетку. Неравноценный транспорт ионов приводит к возниконовению мембранного потенциала. Различные вещества, в том числе лекарственные препараты, яды влияют на активность Na+, К+-АТФазы. Например, сердечные гликозиды, адреналин, соли железа, меди и др. изменяют электрохимический потенциал. Большинство продуктов питания богато калием и бедно натрием (табл. 7). Таблица 7
Калий – элемент IА-группы, IV периода ПСЭ, порядковый номер 19, атомная масса 39,098, щелочной металл. Открыт и впервые выделен в чистом виде Г.Дэви в Электронная формула 1 s 22 s 22 p 63 s 23 p 6 4 s 1. Так как на внешнем энергетическом уровне находится один валентный электрон, то валентность равна I и устойчивая степень окисления +1 (К2О, КОН, КCl). Значение восстановительного потенциала (jо(К+/К) = –2,92 В) указывает на сильные восстановительные свойства элемента калия, поэтому в водной среде устойчив только катион калия. Вследствие незначительного поляризующего действия комплексообразование для калия малохарактерно (как и других щелочных металлов), однако он способен образовывать комплексные соединения с некоторыми биолигандами. Вследствие большой химической активности в природе в свободном состоянии не встречается. Калий входит в состав многих минералов и горных пород: полевой шпат, слюда, нефелин, элеолит, лейцит и др. Калий содержится во всех растениях, особенно много его в плодах. Морская вода содержит в среднем 0,06% KCl. Биологическая роль. В организм соединения калия поступают с пищей. Много калия содержится в молочных продуктах: мясе, какао, томатах, бобовых, картофеле, петрушке, абрикосах, изюме, черносливе, бананах, дыне и черном чае. Взрослый человек потребляет в день 2200–5000 мг калия, дети – 530 мг. В организме взрослого человека содержится 160-180 г калия (~0,23% от общей массы тела). Биоусвояемость калия организмом составляет 90-95%. Калий является основным внутриклеточным катионом, его концентрация в клетках» в 30 раз больше, чем вне их. Главная функция калия – формирование трансмембранного потенциала (K+in > K+out) и распространение изменения потенциала по клеточной мембране путем обмена с ионами натрия по градиенту концентраций. Высокие внутриклеточные концентрации ионов калия необходимы, прежде всего, для синтеза белка на рибосомах и активации ферментов, катализирующих окисление углеводов до пировиноградной или молочной кислоты. В эритроцитах ионы K+ активируют фермент карбоангидразу, катализирующая реакцию: Н2О + СО2 Н2СО3, а также регулируют активность важнейших ферментов как пируватфосфокиназа, ацетилкиназа. Хлориды калия и натрия (сильные электролиты) участвуют в генерации и проведении электрических импульсов в нервной и мышечной ткани. Калий вызывает расширение сосудов внутренних органов и сужение периферических сосудов, что способствует усилению мочевыделения. Калий замедляет ритм сердечных сокращений. Ионы калия участвуют в поддержании гомеостаза (ионное равновесие, осмотическое давление). Пониженное содержание калия в организме увеличивает риск нарушений проводимости и обменных процессов в миокарде, сопровождается нарушениями регуляции артериального давления. Дефицит калия способствует развитию эрозивных процессов слизистых оболочек, возрастает риск прерывания беременности, развития бесплодия. Гиперкалиемия (накопление калия в крови > 0,06%) приводит к тяжелым отравлениям, сопровождающимся параличом скелетных мышц: при концентрации калия в крови больше 0,1%, наступает смерть. Синергистом калия является магний. Антагонистами калия являются натрий, цезий, рубидий, таллий. При отравлении солями таллия вводят соли калия для ускорения выведения таллия из организма. Токсическая доза для человека: 6 г. Летальная доза для человека: 14 г. В медицине применяются препараты калия органические (ацетат, аспарагинат, оротат) и неорганические (хлорид калия), действие которых определяется специфической биологической активностью ионов калия. Препараты калия вводят через рот (per os) и внутривенно. Препараты калия широко применяются как противоаритмические. КО2 используют для получения кислорода и поглощения СО2 в замкнутых объектах: 4КО2 + 2СО2 = 2К2СО3 + 3О2
Натрий – элемент IА-группы, III-го периода ПСЭ, порядковй номер 11, атомная масса 22,99. Открыт Г.Дэви в 1807 г. Название происходит от лат. natrium. Электронная формула 1 s 22 s 22 p 6 3 s 1. Валентность равна I, степень окисления +1 (Na2O, Na2O2, NaOH, NaHCO3). В природе в свободном виде не встречается, вследствие большой химической активности. Самым распространенным соединением натрия является NaCl. Вода морей и океанов содержит до 3% NaCl. Биологическая роль. Натрий входит в состав всех организмов растительного и животного мира. Естественное содержание натрия в пищевых продуктах относительно невелико (15-80 мг%). Относительно много натрия содержится в красной свекле, сельдерее, одуванчике, цикории, моркови, морской капусте. Для соления блюд лучше использовать чистую морскую соль, так как она в меньшей степени задерживает воду в организме. Потребность в натрии минимально составляет около ≈ 1 г/сутки и в значительной степени удовлетворяется обычной диетой без добавления пищевой соли (0,8 г/сут). Особенно это касается маленьких детей. Суточное потребление натрия взрослыми составляет 1100-3300 мг, а детьми – 260 мг. Потребность в натрии возрастает при сильном потоотделении (почти в 2 раза) в условиях жаркого климата или сильных физических нагрузок. С содержанием натрия связывают также способность тканей удерживать воду. Избыточное потребление поваренной соли перегружает сердце и почки (при образовании мочи они перерабатывают кровь с повышенным содержанием натрия). В результате отекают ноги и лицо. Вот почему при заболеваниях почек и сердца рекомендуется резко ограничить потребление соли. Использование пищевой соли в питании должно быть строго индивидуально. В организм человека натрий поступает ежедневно в виде NaCl в достаточно больших количествах: 12-15 г. Хлорид натрия содержится во многих пищевых продуктах: колбаса, сало, соленая рыба, икра, сыр, соленья, маслины, кетчуп, кукурузные хлопья. Ионы натрия быстро и полностью всасываются на всех участках ЖКТ и в местах парентеральных инъекций. Содержание натрия в организме взрослого человека составляет 0,08% (55-60 г на 70 кг массы тела). Натрий распределяется по всему организму, около 40% натрия находится в костной ткани, в основном, во внеклеточной жидкости, его концентрация во внеклеточной жидкости в Ионы натрия поддерживают осмотическое давление жидкостей организма, кислотно-щелочное равновесие (совместно с анионами НСО Внутри клеток натрий необходим для поддержания нейромышечной возбудимости и работы Na+–K+ насоса, обеспечивающих регуляцию клеточного обмена различных метаболитов, от него зависит транспорт аминокислот, сахаров, различных неорганических и органических анионов через мембраны клеток. Недостаток хлористого натрия вызывает тяжелые расстройства, которые проявляются исхуданием, слабостью, выпадением волос, кожными сыпями, поносами, судорогами. Избыточное поступление ионов Na+ вызывает перегрузку соответствующих систем гомеостаза и нарушением метаболических процессов. Отравления соединениями натрия встречается не часто, и носят случайный характер. Токсичность солей натрия определяется токсичностью их анионов (арсенит, хромат, фторид). Токсичность хлорида натрия составляет 8,2 г/кг веса при пероральном введении. Механизм токсического действия NaCl в месте введения обусловлен прежде всего высоким осмотическим давлением, что приводит к обезвоживанию и нарушению функций клеток. В медицине 0,9%-ный раствор NaCl в виде изотонического раствора применяют при обезвоживании организма, как дезинтоксикационное средство, а также для промывания ран, глаз, слизистой оболочки носа; 3–5%-ный раствор NaCl в виде гипертонического раствора используется в хирургии для очищения ран; 10%-ный раствор NaCl применяют внутривенно при легочных, желудочных, кишечных кровотечениях; 2–5%-ный раствор NaCl назначают при атонии кишечника и для промывания желудка при отравлениях нитратом серебра. Натрий-органические и калий-органические соединения – большая группа фармакологических препаратов (салицилат натрия, оротат калия и т.д.). Ионы натрия быстро и полностью всасываются на всех участках ЖКТ и в местах парентеральных инъекций. NaHCO3 используют как отхаркивающее средство, для ингаляций, полоскания полости рта и глаз при воспалении слизистых; Na2B4O7×10H2O – антисептическое средство, вследствие гидролиза: Na2B4O7 + 7H2O 4Н3ВО3 + 2NaOH, применяют для полосканий, спринцеваний и смазываний; Na2SO4×10H2O (глауберова соль) – слабительное средство; Na2O2 – также как и КО2 применяют для получения О2 и поглощения СО2 в замкнутых помещениях (подводные лодки, космические корабли).
Магний – элемент IIА-группы, III периода ПСЭ, порядковый номер 12, атомная масса 24,305. Открыт Джозефом Блэком в 1755 г., а впервые выделен в чистом виде Гемфри Дэви в 1808 г. Название происходит от греческого magnesia (полуострова в Греции). Электронная формула 1 s 22 s 22 p 6 3 s 2, валентность равна II, степень окисления +2 (MgO, Mg(OH)2, MgSO4). Комплексообразующая способность у катиона Mg2+ больше, чем у Na+ и К+. Катион Mg2+ склонен образовывать комплексные соединения с кислород- и фосфатсодержащими лигандами, что и является характерной особенностью этого элемента в условиях организма. Магний один из самых распространенных элементов в природе. Верхний слой земли глубиной до 16 км содержит»3,45% магния. Магний входит в состав различных горных пород: магнезита, доломита, карналлита. Сульфата и хлорида магния особенно много в морской воде. Биологическая роль. В организме среднего человека (масса тела У беременных суточная потребность в магнии 400-500 мг, поскольку этот период связан с его усиленным выделением из организма. Потребность в магнии возрастает у кормящих матерей, спортсменов и в молодом возрасте. Повышенное содержание магния необходимо при борьбе с лишним весом (низкокалорийные диеты и т.д). Также необходимо увеличивать суточную норму при сильном потоотделении, значительных потерях организмом воды (жара, занятия спортом, рвота, диарея), при неумеренном употреблении алкоголя, нарушениях пищеварения (желудочно-кишечные заболевания, диабет и т.д.). Возможные симтомы нехватки магния: ничем не объяснимое чувство тревоги, стресс, нарушение сердечного ритма, судороги мышц (особенно ночные судороги икроножных мышц), бессонница, депрессия, мышечное подергивание, покалывание в кончиках пальцев, головокружение, постоянное чувство усталости, приступы мигрени. Поэтому, особенно в наше время, когда каждый подвержен стрессу, магний является особо важным минеральным веществом. Магний является важнейшим внутриклеточным элементом и после ионов K+ играет важную роль в поддержании осмотического давления внутри клеток. Магний в клетках организма служит активатором многих ферментных процессов: регулирует многие этапы синтеза белков, жирных кислот и липидов, синтез и распад нуклеиновых кислот, участвует в метаболизме углеводов (активирует ферменты окислительного фосфорилирования), активирует ферменты, участвующие в процессах минерализации костной ткани. Ионы Mg2+ вызывают ассоциацию рибосом, образуют комплексы с молекулами АТФ и АДФ, что способствует их активному гидролизу, сопровождающемуся выделением энергии. Mg2+ + АТФ4– ® MgАТФ2– Mg2+ + АДФ3– ® MgАДФ– Содержание магния в сыворотке крови, является диагностическим тестом при ряде заболеваний (злокачественные новообразования, болезни почек, суставов). Содержание ионов Mg2+ в плазие крови строго постоянно, и составляет у взрослых 1,7-2,8 мг%. Магний содержится в крови в ионизированном состоянии (55-60%), связан с белками (≈30%), а 10-15% входит в состав комплексов с липидами, нуклеотидами (АТФ, АДФ). В зеленых растениях ион Mg2+ входит в состав хлорофилла, обеспечивающего кумуляцию энергии. В медицине MgSO4×7H2O (магнезия, английская соль) применяется в качестве слабительного, желчегонного и болеутоляющего средства при спазмах желчного пузыря. Раствор сернокислой магнезии используют при эклампсии, эпилепсии, хорее, тетании, бронхиальной астме, гипертонии. Магнийорганические и кальцийорганические соединения – группа фармакологических общеукрепляющих средств. Препараты магния нормализуют артериальное и внутричерепное давление, предотвращают судорожное сокращение мышц, снимают спазмы сосудов, синдром хронической усталости, способствуют снижению холестерина в крови. Оксид магния, MgO (жженная магнезия), основной карбонат магния Mg(OH)2×4MgCO3×H2O – применяют при повышенной кислотности желудочного сока. Трисиликат магния, 2MgO×3SiO2×(H2O)n – адсорбирующее, обволакивающее и антацидное средство.
Французские биологи считают, что магний поможет медикам в борьбе с таким серьезным недугом XXI в., как переутомление. Исследования показывают, что в крови уставших людей содержится меньше магния, чем у здоровых, а даже самые ничтожные отклонения «магниевой крови» от нормы не проходят бесследно. Важно помнить, что в тех случаях, когда человек часто и по любому поводу раздражается, магний, содержащийся в организме, «сгорает». Вот почему у нервных, легко возбудимых людей нарушения работы сердечных мышц наблюдаются значительно чаще. Кальций – элемент IIА-группы, IV периода ПСЭ, порядковый номер 20, атомная масса 40,08. Выделен в 1808 г. Г. Дэви. Название происходит от лат. calx (известь). Электронная формула 1 s 22 s 22 p 63 s 23 p 6 4 s 2, валентность равна II, степень окисления +2 (СаО, Са(ОН)2, СаCl2). По распространенности в земной коре составляет 5-е место. Биологическая роль. Кальций является важной составляющей частью организма, его общее содержание около 1,4% (1000 г на 70 кг массы тела). Основная его масса (~99%) сосредоточена в костях и зубах и лишь 1% содержится в других органах и тканях. В плазме крови человека содержание ионов Са2+ составляет 2,5 ммоль/л, из которых 46% находится в свободном виде, 40% связаны с белками, а 14% – с лактатами, цитратами. Суточная потребность организма взрослых в кальции 800-1200 мг и покрывается обычно за счет поступления пищи. Суточная потребность детей в кальции 420 мг. Значительное количество кальция содержится в молочных продуктах (сливки, молоко, сыр, творог), в меньших количествах в овощах (бобы, фасоль), орехах, рыбе, огородной зелени (петрушка, шпинат). Биоусвояемость кальция составляет 25-40%. В организм должен поступать в определенном соотношении с фосфором. Оптимальным соотношением этих элементов принято считать 1: 1,5 (Са: Р). Катионы Са2+, входящие в состав плазмы крови и тканевых жидкостей, участвуют в поддержании гомеостаза (ионное равновесие, осмотическое давление в жидкостях организма), в регуляции сердечных сокращений и свертываемости крови. Связывание ионов Са2+ цитратом натрия используют для предотвращения свертывания крови. Кальций очень активен: доминирующее положение этого элемента в конкуренции с другими металлами и соединениями за активные участки белков определяется его химическим особенностями – наличием двух валентностей и сравнительно небольшим атомным радиусом, поэтому кальций может успешно конкурировать с радионуклидами и тяжелыми металлами на всех этапах метаболизма. Ионы кальция Са2+ участвуют в регуляции проницаемости клеточных мембран, электрогенезе нервной, мышечной, железистой тканей, в процессах синаптической передачи, молекулярном механизме сокращения мышц. Ионы кальция участвуют в процессе свертывания крови. Главная роль в метаболизме кальция принадлежит костной ткани. В состав костного матрикса наряду с белком коллагеном входит устойчивая при рН = 7,4 форма фосфата кальция – гидроксифосфат кальция Са5(РО4)3ОН. Образование Са5(РО4)3ОН происходит в остеобластах при рН=8,3: Са+2 + НРО 3СаНРО4 + 2ОН– + 2Са2+ Са4Н(РО4)3 + 2Н2О Са4Н(РО4)3 + 2ОН– + 2Са2+ Са5(РО4)3ОН + Н2О В ряду СаНРО4 ® Са4Н(РО4)3 ® Са5(РО4)3ОН растворимость уменьшается, что способствует образованию последнего соединения. K s(Са5(РО4)3ОН) = 1,6∙10–58 В костную ткань входят в небольшом количестве магний (Mg5(РО4)3F), фтор (в зубной ткани обязательный компонент Са5(РО4)3F, СаСО3, CaSO4), кальций, связанный с органическими кислотами. Костная поверхность организма около 2000 км2, поддерживает концентрацию ионов Са2+ в биологических жидкостях на постоянном уровне. Клетки костной ткани могут ускорять либо отложение (остеобласты), либо растворение (остеокласты) минеральных компонентов. Высокая концентрация свободного ионизированного кальция в плазме (гиперкальциемия) приводит к отложению его солей в почках – кальцификация почечных канальцев, угнетает нервно-мышечную возбудимость поперечно-полостаой и гладкой мускулатуры, может вызвать внезапную остановку сердца. Для лечения гиперкальциемии назначают внутрь фосфат натрия, который в просвете кишечника связывает Са2+ в фосфат кальция, не всасывающийся в кровь и удаляет его из организма. При низких концентрациях ионов Са2+ в крови (гипокальциемия) развивается повышенная нервно-мышечная возбудимость, судороги. Гипокальциемию лечат витамином D, который стимулирует всасывание кальция из желудочно-кишечного тракта, кальцийсодержащими препаратами (глюконат кальция). Токсическое действие кальция проявляется только при длительном приеме. Отравление может наступить при регулярном потреблении более 2,5 г кальция в сутки. В медицине широко применяются многие препараты кальция. Так, CaCl2 применяют при аллергических заболеваниях и осложнениях, связанных с усиленным выведением кальция из организма, отравлениях солями магния, фтористой кислоты и др.; глюконат и лактат кальция применяют в тех же случаях, что и хлорид кальция; СаО – в санитарии и гигиене как дезинфицирующее средство; СаSO4×2H2O (гипс) и 2СаSO4×H2O (алебастр или полуводный гипс) – при наложении гипсовых повязок; осажденный СаСО3 усиливает секрецию желудочного сока, входит в состав зубных порошков; глицерофосфат кальция – как общеукрепляющее средство; искусственные радиоактивные изотопы кальция в медико-биологических исследованиях при изучении кальциевого рбмена.
Железо – элемент VIIIБ-группы, 4-го периода ПСЭ, порядковый номер 26, атомная масса 55,85. Железо высокой чистоты — это блестящий серебристо-серый, пластичный металл, хорошо поддающийся различным способам механичской обработки. Электронная конфигурация: 1 s 22 s 22 p 63 s 2 3 d 64 s 2. Так как число валентных электронов равно восьми, то высшая положительная степень окисления атома железа должна быть равна +8, однако, таких соединений неизвестно, но известны соли железной кислоты Биологическая роль. В организме взрослого человека содержится около 5 г железа, из которых две трети этой массы входит в состав гемоглобина. Считается, что оптимальная интенсивность поступления железа составляет 10-20 мг/сутки. Если поступление этого элемента в организме будет менее 1 мг/сутки, то может развиться дефицит железа. Порог токсичности железа составляет 200 мг/сутки. Важная биологическая роль железа была установлена еще в 18 веке. Основной функцией железа в организме является перенос кислорода и участие в окислительных процессах (посредством десятков железосодержащих ферментов). Железо входит в состав гемоглобина, миоглобина, цитохромов, пероксидазы, каталазы. Много железа содержится в клетках мозга. Гемоглобин обеспечивает внешнее дыхание, являясь переносчиком кислорода от легких к тканям. Миоглобин, цитохромы, каталаза обеспечивают клеточное дыхание. Гемоглобин состоит из белковой части молекулы – глобина и гема – комплексного соединения железа(II) с порфирином. Координационное число железа(II) равно шести: четыре связи с азотом порфирина, одна – с азотом гистидина глобина и еще одна – с кислородом. Именно железо придает молекуле гемоглобина уникальное свойство – способность захватывать молекулярный кислород. Превращение гемоглобина в оксигемоглобин происходит без изменения степени окисления железа. Присоединение кислорода сопровождается отщеплением протона и образуется оксигемоглобин, при этом имеет место равновесие: HHb + O2 HbO При поступлении бедной кислородом венозной крови в легкие, где парциальное давлен
|


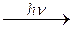 NO + O
NO + O и NO
и NO  . Кислотный оксид при взаимодействии с водой образует азотную кислоту.
. Кислотный оксид при взаимодействии с водой образует азотную кислоту.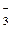 + 2H+ + 2 e = NO
+ 2H+ + 2 e = NO  + H2O.
+ H2O. , НРО
, НРО  , Н2РО
, Н2РО  и анионами органических кислот), удерживают воду в организме (15 г NaCl задерживает до двух литров жидкости), оказывают значительное влияние на белковый обмен.
и анионами органических кислот), удерживают воду в организме (15 г NaCl задерживает до двух литров жидкости), оказывают значительное влияние на белковый обмен. Опыты, проведенные венгерскими учеными на животных, показали, что недостаток магния в организме повышает предрасположенность к инфарктам. Одним собакам давали пищу, богатую солями этого элемента, другим – бедную. К концу эксперимента те собаки, в рационе которых было мало магния, "заработали" инфаркт миокарда.
Опыты, проведенные венгерскими учеными на животных, показали, что недостаток магния в организме повышает предрасположенность к инфарктам. Одним собакам давали пищу, богатую солями этого элемента, другим – бедную. К концу эксперимента те собаки, в рационе которых было мало магния, "заработали" инфаркт миокарда.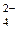 СаНРО4 (тв)
СаНРО4 (тв)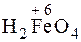 , например K2FeO4. Наиболее характерные степени окисления +2 и +3 (
, например K2FeO4. Наиболее характерные степени окисления +2 и +3 (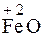 ,
, 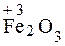 ). Железо – металл средний активности. В природе встречается в виде многочисленных минералов, но встречается и самородное железо (космического или земного происхождения). В земной коре железо распространено достаточно широко — на его долю приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В морской воде 1·10–5–1·10–8% железа. Железо – составная часть гемоглобина.
). Железо – металл средний активности. В природе встречается в виде многочисленных минералов, но встречается и самородное железо (космического или земного происхождения). В земной коре железо распространено достаточно широко — на его долю приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В морской воде 1·10–5–1·10–8% железа. Железо – составная часть гемоглобина.


