Следовательно, макроэргическим является не разрыв связи, а энергетический результат ее гидролиза.
Промежуточное значение свободной энергии гидролиза позволяет служить АТФ эффективным переносчиком фосфатных групп от соединений, которые при гидролизе выделяют больше энергии, чем АТФ, к фосфорилированным соединениям, выделяющим меньше свободной энергии при гидролизе, чем АТФ. Например: фосфатная группа от соединения Концентрация АТФ в клетках поддерживается на относительно постоянном уровне, т.к. скорость его образования приблизительно равна скорости гидролиза АТФ. В организме содержится около 30 г АТФ, которые постоянно подвергаются гидролизу с последующим ресинтезом. 3) Входят в состав фосфатной буферной системы Н2РО Фосфатная буферная система состоит из слабой кислоты Н2РО Н2РО НРО Эта система обеспечивает значительную долю буферной емкости крови, а также играет большую роль в почках, поддерживая рН за счет выведения с мочой гидро- или дигидрофосфатов. Это объясняет широкий интервал значений рН мочи: 4,8 – 7,5. В медицинской практике применяются соединения фосфора: эфир фосфорной кислоты – фосфэстрол при раке предстательной железы; дигидрофосфат натрия NaH2PO4 – при повышенной кислотности желудочного сока, при отравлении кислотами. Производные фосфорной кислоты: фитин, глицерофосфат кальция, фосфрен и др. применяются при заболеваниях нервной системы. Некоторые лекарственные препараты применяются в форме солей фосфорной кислоты – фосфатов. Сера
Элементарную природу серы установил в 1789 А. Лавуазье. В названиях химических соединений, содержащих серу, часто содержится приставка «тио» (например, применяемый в фотографии реактив Na2S2O3 имеет название тиосульфат натрия). Происхождение этой приставки связано с греческим названием серы — theion.
Электронная формула 1 s 22 s 22 р 63 s 23 p 4. Появление 3 d -подуровня у атомов серы в сравнении с атомами кислорода приводит к: а) увеличению валентных возможностей и положительных степеней окисления серы за счет ее перехода в возбужденное состояние:
б) увеличению числа типов гибридизации – sp 3, sp 3 d 2; в) дополнительному p–взаимодействию, упрочнению связи между атомами серы и образованию гомоцепных производных (S8, полисульфаны, полисульфиды). Большой радиус атома серы, невысокая электроотрицательность, наличие внутреннего экрана 2 s 22 р 6 и вакантных 3 d -орбиталей во внешнем слое способствуют уменьшению энергии серусодержащих связей и увеличению поляризуемости как связей, так и неподеленных электронных пар внешнего слоя. В связи с этим, атом серы – «мягкая» частица, и в соответствии с принципами теории ЖМКО склонна к взаимодействию с «мягкими» реагентами. При нагревании сера непосредственно взаимодействует со всеми веществами, за исключением азота, золота, платины. При этом она проявляет как окислительные, так и восстановительные свойства: S + H2 = H2S; S + 3F2 = SF6 S – окислитель S – восстановитель Сера с водой и разбавленными кислотами при обычных условиях не реагирует. При кипячении в щелочах диспропорционирует: 3S + 6KOH = K2SO3 + 2K2S + 3H2O. Сера – весьма распространенный элемент в природе, присутствует в земной коре в виде свободной серы, сульфидов и сульфатов, которых много в гидросфере. Животные получают серу только за счет растительной пищи. Содержание серы в организме человека составляет 0,16% или ~112 г на 70 кг веса. Суточная потребность взрослого человека в сере около 4-5 г. Сера входит в состав белков, серусодержащих аминокислот (цистеина, цистина, метионина), является составной частью сульфгидрильных групп (HS–), гормонов (инсулин), витаминов (витамин В1), много серы в каротине волов, шерсти, костях, нервной ткани и т.д. В организме сера окисляется с образованием эндогенной серной кислоты, которая участвует в обезвреживании ядовитых соединений, образующихся в кишечнике из аминокислот (фенол, крезол, скатол, индол), а также чужеродных соединений, например, лекарственных препаратов. С этими соединениями серная кислота образует эфиры, которые выводятся из организма с мочой: С6Н5ОН + H2SO4®С6Н5–ОSO3H + H2O. В организме сера в степени окисления –2 окисляется легче, чем углерод органических соединений. Поэтому именно тиолы R–SH проявляют защитные свойства относительно окислителей и активных радикалов. При мягком окислении тиолов происходит образование дисульфидов: 2R–SH R–S–S–R +2 Таким образом может окисляться цистеин, превращаясь в цистин:
Цистеинсодержащие белки образуют дисульфидные связи, вследствие чего изменяются их конформация и биологическая функция. Для защиты таких белков в организме существуют так называемые тиоловые протекторы: глутатион (G–SН) – трипептид, содержащий цистеин, и дигидролипоевая кислота. Окисляясь сами, они предотвращают окисление белков, т.е. «берут удар» на себя. Так как процесс окисления обратим, то в организме поддерживается тиол-дисульфидное равновесие, которое позволяет регулировать активность ферментов и гормонов, свертываемость крови, проницаемость мембран. Тиоловые протекторы защищают организм и от радиационного воздействия, т.к. в результате взаимодействия радикалов • О RSH + • ОН = RS• + H2O; RS • + • SR = R–S–S–R Тиолы являются также хорошими нуклеофильными реагентами благодаря высокой поляризуемости серы, поэтому в организме они хорошо взаимодействуют с алкилирующими реагентами, в том числе и с отравляющими веществами, нейтрализуя их действие. Тиолсодержащие биосубстраты, в том числе ферменты (Ф-SH) являются мягкими и активными лигандами, которые взаимодействуют с катионами тяжелых металлов (мягкими комплексообразователями) с образованием прочных комплексов: 2 Ф–SH + Hg2+ ® Ф–S–Hg–S–Ф + 2Н+. В результате такой реакции субстрат или фермент теряет активность, поэтому ионы тяжелых металлов являются токсикантами. Вследствие большого сродства ионов серебра Ag+ к тиоловым группам, нитрат серебра используют в титриметрическом анализе для количественного определения SH-групп, что позволяет оценивать буферную емкость антиоксидантной системы организма. При гниении белковых веществ под действием микроорганизмов образуется важнейшее соединение серы – сероводород. Сероводород H2S – бесцветный газ с запахом гниющего белка, очень токсичен. Водный раствор H2S – слабая сероводородная кислота: H2S + Н2О Н3О+ + HS– p K 1 = 7,3 HS– + Н2О Н3О+ + S2– p K 2 = 13,8. Сероводородная кислота образует два типа солей: сульфиды и гидросульфиды, которые в воде легко гидролизуются по аниону. Сероводород и сульфиды – сильные восстановители. Восстановительные свойства сероводорода лежат в основе деятельности анаэробных бактерий (фотосинтез): n CO2 + 2 n H2S (CH2O) n + n H2O + 2 n S. Сероводород – это сильный нейротоксичный яд, т.к. связывая атомы меди в цитохромоксидазе блокирует перенос электронов с этого фермента дыхательной цепи на кислород. При содержании в воздухе
|

 /НРО
/НРО 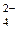 (1/4 – биологическая константа).
(1/4 – биологическая константа). Сера расположена в ПСЭ в III периоде, в VIA-группе.
Сера расположена в ПСЭ в III периоде, в VIA-группе. + 2Н+.
+ 2Н+.
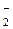 , НО
, НО  , • ОН с тиолами образуются менее активные радикалы RS •, которые могут самоликвидироваться, взаимодействуя друг с другом.
, • ОН с тиолами образуются менее активные радикалы RS •, которые могут самоликвидироваться, взаимодействуя друг с другом.


