Справочный (теоретический) материал, необходимый для понимания задания и выполнения работ.
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита. Сущность электролиза состоит в том, что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно. Электролиз расплава и раствора отличаются друг от друга. В растворе соли кроме ионов металла и кислотного остатка присутствуют молекулы воды и ионы Н+ и ОН- - продукты диссоциации воды. Поэтому при рассмотрении реакций на электродах необходимо учитывать возможность участия молекул воды в электролизе.
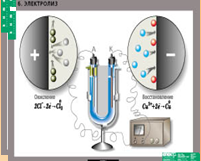
Рис.1. Прибор (электролизер) для проведения электролиза водных растворов солей.
Процесс на катоде не зависит от материала катода, а зависит от положения металла в электрохимическом ряду (табл 1.). Таблица 1
Процессы, протекающие на аноде, погруженном в водный раствор электролита, зависят от материала, из которого изготовлен анод, а также и от природы аниона. Анион, который входит в состав электролита может являться остатком как бескислородной кислоты, так и кислородсодержащей кислоты. (табл.2). Таблица 2
Пример 1: Электролиз расплава сульфата натрия Na2SO4 ↔ 2 Na+ + SO42− К(-) Na+ + ē = Na0 4 А(+) 2SO42− − 4ē = 2SO3 + O2 1
4Na+ + 2SO42− = 4Na0 + 2SO3 + O2 2 Na2SO4 = 4Na0 + 2SO3 + O2
Пример 2: Электролиз раствора хлорида калия (анод нерастворимый) KCl ↔ K+ + Cl− H2O↔ Н+ + OH− K(-) 2H2O + 2 ē = H2↑+ 2OH− А(+) 2Cl− − 2ē = Cl20↑
2H2O + 2Cl− = H2↑+ 2OH− + Cl20↑ 2 KCl +2H2O = H2↑+ 2KOH- + Cl20↑
Пример 3:Электролиз водного раствора хлорида цинка (анод нерастворимый) ZnCl2 ↔ Zn2+ +2Cl- H2O↔ Н+ + OH− (вода слабый электролит) K(-) Zn2+ + 2ē = Zn0 2H2O + 2 ē = H2↑+ 2OH- А(+) 2Cl- - 2ē = Cl20↑
Суммарное уравнение реакции в данном примере написать нельзя, так как неизвестно, какая часть общего количества электричества идет на восстановление воды, а какая – на восстановление ионов цинка.
Пример 4: Электролиз раствора сульфата меди (II) (анод нерастворимый) CuSO4 ↔ Cu2+ + SO42- H2O ↔ Н+ + OH− K(-) Cu2+ + 2ē = Cu0 2 А(+) 2H2O - 4ē = О2↑+ 4H+ 1
2Cu2+ +2H2O = 2Cu0+О2↑+ 4H+ 2CuSO4 + 2H2O = 2Cu0 + О2↑+2H2SO4
Пример 5: Электролиз водного раствора нитрата серебра с активным (растворимым) анодом из серебра AgNO3↔Ag+ + NO3− H2O ↔ Н++OH− K(-) Ag+ + ē = Ag 0 А(+)Ag 0 – ē = Ag+
Составить молекулярное уравнение электролиза раствора нитрата серебра, с растворимым анодом невозможно. Это означает, что электролиз раствора нитрата серебра сводится к переносу серебра с анода на катод. Вопросы к защите работы 1. Чем отличается электролиз с нерастворимым анодом от электролиза с растворимым анодом? 2. Есть ли отличия при проведении электролиза раствора и расплава? Ø Учебная литература:/1/, с.281 - 286 /2/, с.556-572; /3/, с.284-291
|