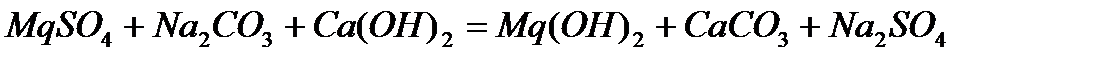Справочный (теоретический) материал, необходимый для понимания задания и выполнения работ.
Примеси, растворенные в воде, оказывают существенное влияние на её свойства. Эти примеси весьма необходимы для жизни человека, животных и растений, но часто оказываются очень вредными для применения воды в технике. Так как эти примеси при высокой температуре образуют плотный осадок на стенках котлов (накипь), осаждаются на стенках труб в системах водяного охлаждения, что приводит к выходу этих систем из строя. Жесткость водопроводной воде придают соли магния, кальция и железа. Различают жесткость временную, постоянную и общую (суммарную). Временная жесткость обусловлена наличием в воде бикарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. При гидролизе соли, образованной слабой двухосновной кислотой H2CO3, процесс реакции идет по следующей схеме: CO32− + HOH = HCO3− + OH− Диссоциация бикарбоната иона: HCO3− = Н+ + CO32− настолько мала КДИСС.= 4,7· 10−11, что произведение растворимости CaCO3 не достигается и осадок не выпадает (ПРCaCO3 = 5· 10−9; ПР MgCO3 = 1· 10−5) При кипячении значительно ускоряются два противоположных процесса: а) Гидролиз иона HCO3− HCO3−+ HOH = H2CO3 + OH−;КГИДР.=3,3· 10−8 СО2 Н2О б) Диссоциация иона HCO3− HCO3− ↔ Н+ + CO32− Процесс диссоциации иона HCO3− делает возможным превышение величин произведения растворимости CaCO3 и MgCO3 и выпадает осадок. Суммарный процесс выражается уравнением: Ca(HCO3)2 ↔ CaCO3 + СО2 + Н2О Равновесие этой реакции при кипячении сильно сдвигается вправо вследствие образования летучего (СО2) и трудно растворимых продуктов. Поскольку бикарбонатная жесткость устраняется кипячением, она называется временной. Постоянная жесткость обуславливает наличие в воде сульфатов, хлоридов и других солей кальция и магния, которые не разлагаются при кипячении воды. Сумма временной и постоянной жесткости составляет общую жесткость воды. Общую жесткость можно определить двумя способами: а) по сумме катионов Ca2+ и Mg2+; б) по сумме анионов HCO3−, SO42−, Cl− и др. Общая жесткость воды оценивается суммой ммоль - эквивалентов ионов кальция и магния, содержащихся в 1 литре. Один ммоль – эквивалентов жесткости отвечает содержанию 20,04 мг/л ионов кальция или 12,16 мг/л ионов магния. Жесткость природных вод колеблется в очень широких пределах – от 0,1 - 0,2 мэкв/л в водах рек и озер, расположенных в зонах тайги и тундры, до 80 - 100 мэкв/л в некоторых подземных водах и водах морей и океанов. Повышенная жесткость в водах природных источников обусловлена контактом воды с горными породами, содержащими карбонаты и сульфаты. Применение жесткой воды недопустимо в некоторых отраслях промышленности, например в теплоэнергетике, так как в котлах и отопительных приборах образуется накипь, что ухудшает теплообмен. Поэтому жесткость является одним из показателей качества воды, который необходимо контролировать. При необходимости использования источника с высокой жесткостью воды применяют специальные методы умягчения воды. Умягчение может быть осуществлено переводом солей жесткости в труднорастворимые или комплексные соединения, перегонкой воды, методом ионного обмена. При умягчении воды методом осаждения соли жесткости переводят в следующие труднорастворимые соединения: карбонат кальция, гидроксид магния, трехзамещенные фосфаты. Способы обработки воды, в зависимости от осадителя, которые применяются дляумягчения воды, называют известкованием, содо-известкованием, фосфатированием. Процессы, протекающие при известковании воды (обработка известью Са(ОН)2) описываются уравнениями реакций:
Постоянная жесткость известью не удаляется – изменяется ее состав: магниевая жесткость переходит в эквивалентное количество кальциевой. Обработка воды одновременно содой
|

 ,
,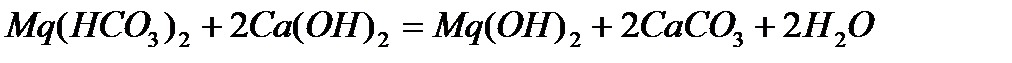 ,
,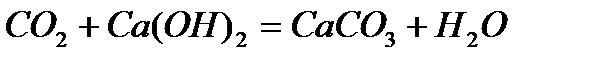 ,
, .
.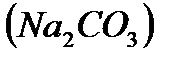 и известью (содо-известкование) может быть описана теми же уравнениями (кроме последнего) и в дополнение к ним следующими:
и известью (содо-известкование) может быть описана теми же уравнениями (кроме последнего) и в дополнение к ним следующими: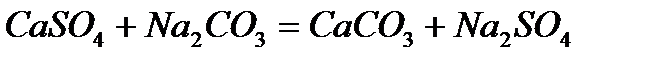 ,
,