Энтропия. жылукөлемі, бір күйден екінші күйге өткендегі берілген немесе алынған жүйеде
Әдетте, келтірілген жылу көлемі – жылу
Интеграл астындағы теңдеу қайсыбір функцияның толық диференциялы, ол жүйедегі күйлердің тек қана бастапқы және соңғы мәндерімен анықталады. Энтропия. S жүйенің күй функциясы деп аталады, фифференциялы
Яғни, термодинамиканың екінші бастамасын F = U – TS функциясы жүйенің күй функциясы және Гельмгольц энергиясы немесе бос энергия деп аталады. Энтропияның өзгеруі. Оқшауланған жүйеде қайтымсыз процесс кезінде жүйенің энтропиясы артады. Сонымен қатар оқшауланған жүйеде процестер энтропия артатын жаққа қарай бағытталады: ∆S > 0 (6.25) Дербес жағдайда жүйеде өтетін процестердің барлығы да қайтымды болғанда энтропия өзгермейді. ∆S = 0 (6.26) (7) және (8) өрнектерге сәйкес термодинамиканың екінші бастамасын басқаша тұжырымдауға болады: қарастырылып отырған процестер қайтымды болса, онда энтропия өзгермей тұрақты болады, ал қайтымсыз процестер үшін ылғи артып отырады.
Бұл Клаузиус теңсіздігі деп аталады.
|

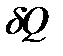 жылукөлемі, бір күйден екінші күйге өткендегі берілген немесе алынған жүйеде, бастапқы және соңғы күйлермен анықталмайды, бірақ осы ауысу тәсіліне тәуелді (
жылукөлемі, бір күйден екінші күйге өткендегі берілген немесе алынған жүйеде, бастапқы және соңғы күйлермен анықталмайды, бірақ осы ауысу тәсіліне тәуелді (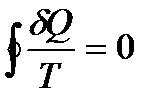

 (6.24)
(6.24) түрінде жазуға болады. Бұдан
түрінде жазуға болады. Бұдан 
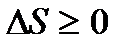 .
.


