Идеал газдың ішкі энергиясы және молекуланың еркіндік жәрежесі
Молекуланың орташа кинетикалық энергиясы
Молекуланың тек ілгерілмелі қозғалысының энергиясын ғана көрсетеді. Алайда молекулалардың ілгерілмелі қозғалысымен қатар, олардың айналуы және қозғалысына қатысатын атомдардың тербелуі де мүмкін. Мұндай қозғалыстың екі түрі бір энергия қорымен байланысты болады да, оны анықтауға статистикалық физика тағайындаған энергияның молекуланың еркіндік дәрежелері бойынша тарлуы жөніндегі қағида мүмкіндік береді. Механикалық жүйенің еркіндік жәрежелері деп жүйенің орнын анықтауға мүмкіндік беретін тәуелсіз шамалардың жиынтығын айтамыз. Материалдық нүктенің кеңістіктегі орны оның үш координаттарының мәндерімен анықталады. Осыған сәйкес материалдық нүктенің үш еркіндік дәрежесі (і = 3) болады. Газдардың жылу сыйымдылығын өлшегенде атомдарды материалдық нүктелер деп есептеуге болады. Демек, бір атомды молекулаға үш ілгерілмелі еркіндік жәрежесін (і = 3), екі атомды молекулаға үш ілгерілмелі және екі айналмалы еркіндік дәрежесін (і = 5), ал үш атомды молекулаға – үш ілгерілмелі, екі айналмалы және бір тербелмелі еркіндік дәрежесін (і = 6) жазуға болады. Бір молекуланың орташа энергиясы:
Мұндағы і – ілгерілмелі, айналмалы және екі еселенген тербелмелі еркіндік дәрежелері сандарының қосындысы, ол:
Идеал газдар теориясында молекулалардың өзара әсерлесу кезіндегі потенциалдық энергия нольге тең болады. Сондықтан идеал газдың ішкі энергиясы оның барлық молекулаларының қозғалысының кинетикалық энергиясы арқылы өрнектеледі. Идеал газдың молекулалары өте жақын қашықтықта әсерлесетін болғандықтан, газдың ішкі энергиясы жеке молекулалардың энергиясының қосындысынан тұрады. Демек, идеал газдың 1 молінің ішкіэнергиясы Авогадро санын бір молекуланың орташа энергиясына көбейткенге тең болады:
Ал массасы m кез келген газ үшін немесе кез келген мольдің саны m/μ үшін ішкі энергия:
Сонымен (6) өрнектен берілген газдың массасы үшін ішкі энергия газ молекуласының еркіндік дәреже көрсеткіші өзгермейтін болма, оның абсолют температурасына тура пропорционал екендігі көрінеді. Тұрақты көлемде идеал газдың молярлық жылу сыйымдылығын алу үшін газдың ішкі энергиясының (67) өрнегін температура бойынша дифференциалдаймыз:
Бұл өрнектен тұрақты көлемде идеал газдың жылу сыйымдылығы газ күйінің параметрлеріне, әсіресе температураға тәуелсіз тұрақты шама екені көрінеді. Тұрақты қысымдағы жылу сыйымдылығын Майердің теңдеуінен табуға болады:
Сонымен (7) және (8) формулалар молекуланың еркіндік көрсеткіші арқылы газдың мольдік жылу сыйымдылықтарын анықтауғы мүмкіндік береді. Енді (69) өрнекті (68) – ге бөліп, әрбір газға тән
Соңғы өрнектен γ шамасы молекуланың еркіндік дәрежесінің саны мен сипаты арқылы анықталады. Мысалы, бір атомды молекула үшін і = 3 болғандықтан:
қатаң екі атомды молекула үшін (і = 5), (2- кесте).
|


 . (6.5)
. (6.5)
 мұндағы Больцманның тұрақтысы
мұндағы Больцманның тұрақтысы 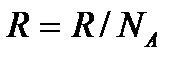 десек, онда ішкі энергия:
десек, онда ішкі энергия:
 (6.6)
(6.6) (6.7)
(6.7)
 (6.8)
(6.8) - нің
- нің  - ге қатынасын табйық:
- ге қатынасын табйық:

 қатаң үш атомды молекула үшін (і = 6) болғанда:
қатаң үш атомды молекула үшін (і = 6) болғанда: 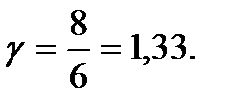 Ең соңында әр түрлі молекулалар үшін
Ең соңында әр түрлі молекулалар үшін  және γ мәндері бар кестені көрсетейік
және γ мәндері бар кестені көрсетейік )
Көп атомды газ(
)
Көп атомды газ( )
Көмір қышқыл газ (
)
Көмір қышқыл газ ( )
)









