Идеал газдың негізгі заңдары
Идеал газ деп молекулалар арасында өзара әсерлесу күштері болмайтын, жеке молекулалар көлемі ыдыс көлемімен салыстырғанда өте аз және молекулалар арасындағы өзара соқтығысуы абсолют серпімді болатын газды атайды. Көптеген тәжірибелер бойынша қалыпты жағдайда (оттек, гелий), яғни төменгі қысымда және жоғары температурада нақты газдар қасиеті идеал газ қасиетіне сәйкес келеді. Молекла – кинетикалық теория ашылғанға дейін идеал газдар қасиетін сипаииайтын көптеген заңдылықтар бар. Бойль – Мариотт заңы. Газ кйіндегі заттардың меншікті көлемі болмайды. Сондықтан газдар ыдысқа толтырылғанда, сол ыдыстың көлемін толық алып тұрады және ыдыс қабырғаларына белгілі бір қысым күшін түсіреді. XVII ғасырдың ортасында ағылшын ғалымы Р. Бойль (1627 - 1691) және француз физигі З. Мариотт (1620 -1684) бір-біріне тәуелсіз жасалған тәжірибе қорытындыларынан, температура тұрақты болғанда газ көлемінің (V) оның қысымына (р) тәуелді өзгеретінін тұжырымдады, яғни берілген газ массасы үшін тұрақты температурада оның қысымы көлеміне кері пропорционал өзгереді, яғни pV = const,
Бұл тәуелділікті изотерма деп аталатын гипербола қисығымен көрсетуге болады (1 - сурет). газ күйінің бір күйден екінші күйге тұрақты температурада өтуі изотермалық процесс деп аталады. Ал нақты газдар бұл заңдылыққа тек тығыздықтары өте аз болғанда ғана бағынады. Сонымен, тұрақты температурада р мен V тәуелділігі заттар қасиетін сипаттайды. Гей – Люссак заңы. Газ көлемінің (V) оның температурасына (Т) тұрақты қысымда (р = const) тәуелді болу шартын бірінші рет француз ғалымы Гей – Люссак (1778 - 1850) тағайындады: берілген газ массасы үшін қысымы тұрақты болғанда, газ көлемі оның температурасына сызықты тәуелді өзгереді (p = const, m=const).
мұндағы Vo – газдың 0оС – тағы көлемі,
2 – сурет Шарль заңы. Тұрақты көлемде газ температурасының қысымға тәуелді болатыны да анықталды, яғни берілген газдың массасы үшін көлемі тұрақты болғанда, газ қысымы оның температурасына сызықты тәуелділікте өзгереді (V = const, m = const)
Мұндағы р – газдың 0оС – тағы қысымы,
Изобара және изохора түзулері обсцисса осінде шамасы Бірліктердің халықаралық жұйесінде Кельвин – температураның термодинамикалық шкаласында негізгі өлшем болып, су күйінің үштік нүктесіне сәйкес келетін термодинамикалық температураның 1/273,15 үлесіне тең болады. Абсолют температура Т мен Цельсий бойынша анықталған t температураның арасында мынадай қатынаста болады:
Мысалы, 0о – қа + 273,15 K сәйкес келеді. 0о К – қа тең температура абсолют ноль деп аталады, оған – 273,15о С мәні сәйкес келеді. Енді (2) және (3) теңдеулерге абсолют температураның мәнін қойып, оны басқа түрде жазуға болады:
Бұдан
Осындай әдіспен изохоралық процесс үшін де мынадай теңдікті жазуға болады, яғни
Авогадро тағайындаған заң бойынша бірдей жағдайларда, яғни бірдей температура мен қысымда барлық газдардың модельдерінің көлемі бідей болады. Қалыпты жағдайда: V = 22,41 Әр түрлі заттардың бір модельдегі молекулалар саны бірдей болады: Ағылшын физигі және химигі Дж. Дальтон (1766 - 1844) тағайындаған заң бойынша, идеал газдар қоспасының жалпы қысымы, сол қоспаны құрайтын газдардығ порциал қысымдардың қосындысына тең болады, яғни
Мұндағы р1, р2 ,р3,... рn – парциал қысымдар. Газ қоспасының құрамына кіретін газдың, егер ол, сол температурада қоспа газдың көлемін толық алған жағдайдағы қысымы парциалдық қысым деп аталады. Сонымен идеал газдың берілген массасы үшін (m = const) жоғарыда қарастырылған заңдылықтар, яғни: pV = const (изотермалық процесс), V/T = const (изобаралық процесс), p/T = const (изохоралық процесс) дұрыс екен. Клайперон - Менделеев теңдеуі (Идеал газ күйі теңдеуі) Термодинамикалық системаның күй теңдеуі деп – термодинамикалық тепе – теңдікте тұрған жұйедегі қысым P, көлем V және температура Т – ны байланыстыратын теңдеуді айтамыз: f = (P, V, T) = 0 мұндағылардың біреуі келесі екеуінің функциясы берілген газ массасы үшін, газ күйінің өзгерісін көрсететін шама (pV) / T әр уақытта тұрақты болады екен, яғни (pV) / T = const. (5.6) Бұл теңдікті бірінші рет француз физигі және инженері С. Клапейрон (1799 - 1864) Бойль – Мариотт және Гей – Люссак заңдарын біріктіріп, қорытып шығарғандықтан, ол идеал газ күйін сипаттайтын Клапейрон теңдеуі деп аталады. Қалыпты жағдай, яғни температура (0оС) және атмосфералық қысым (ро = 1,01
Енді (8) теңдеуден универсал газ тұрақтысының сандық мәнін анықтап шығарайық. Егер Т = 273 К, р = 1,01
Бұд теңдік m кез келген газ үшін қорытылып шығарылған Клапейрон – Менделеев теңдеуі болып табылады.
|

 (5.1)
(5.1)




 - газдың көлемдік ұлғаюының термиялық коэффициенті. Тұрақты қысымда газ көлемі мен температура тіуелділігі графикте түзу сызықпен көрсетіледі. Қысымның әрбір мәніне сәйкес келетін түзу сызық изобара деп аталады (2 - сурет). Ал газ күйінің тұрақты қысымда өзгеруі изобаралық процесс делінеді.
- газдың көлемдік ұлғаюының термиялық коэффициенті. Тұрақты қысымда газ көлемі мен температура тіуелділігі графикте түзу сызықпен көрсетіледі. Қысымның әрбір мәніне сәйкес келетін түзу сызық изобара деп аталады (2 - сурет). Ал газ күйінің тұрақты қысымда өзгеруі изобаралық процесс делінеді.


 (5.2)
(5.2)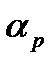 - газ қысымының термиялық коэффициенті. Көлем тұрақты болғанда, р мен t тәуелділігі түзу сызықты және ол изохора деп аталады. Газ күйінің мұндай өзгеруін изохоралық процесс дейді. Зерттеудің нәтижелері газдардың термиялық коэффициенттері
- газ қысымының термиялық коэффициенті. Көлем тұрақты болғанда, р мен t тәуелділігі түзу сызықты және ол изохора деп аталады. Газ күйінің мұндай өзгеруін изохоралық процесс дейді. Зерттеудің нәтижелері газдардың термиялық коэффициенттері 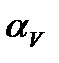 мен
мен  бір – біріне шамалас екенін көрсетеді, яғни
бір – біріне шамалас екенін көрсетеді, яғни
 нүктесінде қиылысады. Температураның бастапқы санау нүктесін осы нүктеге ауыстырып, температураның Цельсий шкаласынан абсолют Кельвин шкаласы деп аталатын басқа температуралық шкалаға өтуге болады.
нүктесінде қиылысады. Температураның бастапқы санау нүктесін осы нүктеге ауыстырып, температураның Цельсий шкаласынан абсолют Кельвин шкаласы деп аталатын басқа температуралық шкалаға өтуге болады.


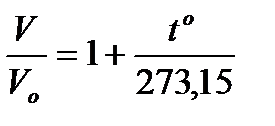 немесе
немесе 
 Егер То мен Vo тұрақты шама екенін ескерсек, онда изобаралық процесс үшін:
Егер То мен Vo тұрақты шама екенін ескерсек, онда изобаралық процесс үшін: (5.3)
(5.3) (5.4)
(5.4) /моль-ге тең.
/моль-ге тең. , бұл Авогадро саны деп аталады.
, бұл Авогадро саны деп аталады. (5.5)
(5.5) 105 Па) болса, онда кез келген газдың бір молінің көлемі 22,41 л = 22,41
105 Па) болса, онда кез келген газдың бір молінің көлемі 22,41 л = 22,41  10-3 м3 болады. Сондықтан газдың сандық мәні бір мольге тең болса, (7) теңдіктегі тұрақты шама барлық газдар үшін бірдей болады. Барлық газ үшін тұрақты шаманы R әрпімен белгілеп, оны универсал газ тұрақтысы деп атайды. Сонда (7) теңдік мына түрде жазылады:
10-3 м3 болады. Сондықтан газдың сандық мәні бір мольге тең болса, (7) теңдіктегі тұрақты шама барлық газдар үшін бірдей болады. Барлық газ үшін тұрақты шаманы R әрпімен белгілеп, оны универсал газ тұрақтысы деп атайды. Сонда (7) теңдік мына түрде жазылады: (5.7)
(5.7) 105 Па,
105 Па,  болса, онда
болса, онда  Дж/(моль К). 1 мольге ғана дұрыс болатын pVo = RT (Vo = V) формуланы кез келген мөлшердегі массаға қолданатындай өзгертіп жазуға болады. Ол үшін газдың молярлық массасын µ әрпімен белгілейміз. Олай болса, тұрақты қысым мен температурада (р1T = const); V = (Vom)/µ;
Дж/(моль К). 1 мольге ғана дұрыс болатын pVo = RT (Vo = V) формуланы кез келген мөлшердегі массаға қолданатындай өзгертіп жазуға болады. Ол үшін газдың молярлық массасын µ әрпімен белгілейміз. Олай болса, тұрақты қысым мен температурада (р1T = const); V = (Vom)/µ; 
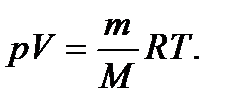 (5.8)
(5.8)


