Газдардың молекула – кинетикалық теориясының негізгі теңдеуі
Молекула – кинетикалық теорияның негізгі теңдеуі газ күйін сипаттайтын параметрлер мен молекулалар қозғалысын байланыстырады, яғни газ қысымы мен көлемінің тәуелділігін және молекулалардың ілгерілмелі еркін қозғалысының кинетикалық энергиясының арасындағы байланысты қарастырады. Көлемі V ыдыста жалпы массасы m, жылдамдығы v, массасы mo, N молекуадан тұратын идеал газ болсын. n = N / V газдағы молекулалар концентрациясы (анықтама бойынша). Егер элементар ауданы Сонымен, газдың ыдыс қабырғасына түсіретін р қысымы көлем бірлігіндегі молекулалардың no санымен, молекуланың m массасымен және олардың v жыламдықтар квадртының орташа мәндерімен анықталады. Соңғы формуланың оң жағын 2 – ге көбейтіп және бөлсек:
Мұндағы
Яғни газдың қысымын оның молекулаларының ілгерілмелі қозғалысының орташа кинеткалық энергиясымен өрнектеуге болады. Сонымен (5.10), (5.11) формулалар газдардың кинетикалық теориясының негізгі теңдеулері деп аталады. Егер де 1 моль газдың көлемі V болса, онда бірлік көлемдегі газ млекулаларының саны n0 = NA / V, осы мәнді (5.11) теңдіке қойсақ
1 моль газ үшін газ күйінің теңдеуін пайдаланып, pV = RT. (12) формуланы былайша түрлендіреміз:
Бұл формуладан газдың абсолют температурасының молекуланың ілгерілмелі қозғалысының орташа кинетикалық энергиясна Е пропорционал екенін көреміз. Соңғы өрнектен молекуланың рташа кинетикалық энергиясын анықтауға болады:
Мұндағы R және NA тұрақты шамалар болғандықтан, олардың қатынасы R /NA = k да тұрақты шама, содықтан бұл шаманы Больцман тұрақтысы деп атайды. Оның сандық мәні:
Енді (13) формулаға Больцман тұрақтысын қойсақ:
Осы формула молекулалардың ілгерілмелі қозғалысының орташа кинетикалық энергиясы тек температураға байланысты екенін және мұнымен қатар оның абсолют температураға тура пропорционал болатынын көрсетеді. Температураны молекула – кинетикалық тұрғыдан түсіндіру: Термодинамикалық температура – газ молекулаларының жылжымалы қозғалысының орташа кинетикалық энергиясының өлшемі. Енді (12) және (14) теңдеулерді біріктіріп қарстырсақ:
Бұдан газ қысымы молекулалар концентрациясына n0 және оның абсолют температурасына пропорционал екені көрінеді. Қалыпты жағдайда, яғни р = 1,01
|

 S тең қабырғамен
S тең қабырғамен  t соғысу уақытысында
t соғысу уақытысында  р импульс берілсе, онда ыдыстығ қабырғасына түсірілген газ қысымы
р импульс берілсе, онда ыдыстығ қабырғасына түсірілген газ қысымы  тең. әрбір соқтығыс кезінде қабырғаға перпендикуляр қозғалатын молекула оған 2mov импульс береді. Жалпы алғанда қабырғаға қарай барлық молекуланың 1/6 бөлігі қозғалады. Енді бір – біріне перпендикуляр 3 осьті қарастырайық, онда әр осьтің бойымен жалпы алғанда молекуланың 1/3 бөлігі қозғалады, және олардың тек ½ (1/3) – тің жартысы ғана берілген бағытта қозғалады. Сондықтан
тең. әрбір соқтығыс кезінде қабырғаға перпендикуляр қозғалатын молекула оған 2mov импульс береді. Жалпы алғанда қабырғаға қарай барлық молекуланың 1/6 бөлігі қозғалады. Енді бір – біріне перпендикуляр 3 осьті қарастырайық, онда әр осьтің бойымен жалпы алғанда молекуланың 1/3 бөлігі қозғалады, және олардың тек ½ (1/3) – тің жартысы ғана берілген бағытта қозғалады. Сондықтан 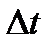 уақытында
уақытында  ауданға
ауданға  молекула жетеді, және оған
молекула жетеді, және оған  импульс береді. Ыдыстың қабырғасындағы газ қысымы
импульс береді. Ыдыстың қабырғасындағы газ қысымы  ;(5.9)
;(5.9) (5.10)
(5.10)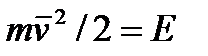 - бір молекуланың ігерілмелі қозғалысының орташа кинетикалық энергиясы, сондықтан
- бір молекуланың ігерілмелі қозғалысының орташа кинетикалық энергиясы, сондықтан (5.11)
(5.11) (5.12)
(5.12) немесе
немесе
 (5.13)
(5.13)
 (5.14)
(5.14)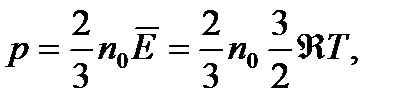 p = nkT
p = nkT 105 Па және T = 2730 K болғанда, кез келген газдың 1м3 көлемінде
105 Па және T = 2730 K болғанда, кез келген газдың 1м3 көлемінде  молекула болады да, бұл сан Лошмидт саны деп аталады.
молекула болады да, бұл сан Лошмидт саны деп аталады.


