Термодинамиканың бірінші бастамасы
Бір дененің толық энергиясынан толық механикалық энергиясын шығарып тастағанда қалатын энергия оның ішкі энергиясы деп аталады. Демек, дененің ішкі энергиясы дегеніміз молекулалардың бейберекет (хаосты) қозғалысының кинетикалық энергиясынан, молекулаларадың өзара әсерлесуінің потенциалдық энергиясынан және ішкі молекулалық энергиясынан тұрады. Денелер жүйесінің ішкі энергиясы әрбір жеке денелердің ішкі энергиялары мен денелер жанасатын жұқа қабаттағы молекулалардың арасындағы өзара әсерлесу энергиясы болып табылады. Ішкі энергия – жүйе күйінің функциясы. Демек, жүйе бір күйден екінші күйге өткен кезде оның ішкі энергиясының өзгерісі әрқашан да ауысу жолына тәуелсіз, яғни жүйенің бір күйінен екінші күйіне келтіретін процесіне немесе процестер жиынына тәуелсіз, тек осы күйлердегі ішкі энергияның мәндерінің айырмасына тең. Ішкі энергия (U) негізінен, екі түрлі процестің: дененің А жұмыс істеуі мен денеге берілген Q жылу мөлшерінің есебінен өзгереді. Жұмыс істеу жүйеге әсер етуші сыртқы денелердің орын ауыстыруымен қоса жүреді. Денеге жылу беру сыртқы денелердің орын ауыстыруына тәуелді емес. Ішкі энергияның бұл жағдайдағы өзгерісі жылы дененің жеке молекулаларының салқынырақ дененің молекулаларына қарсы істеген жұмысының әсерінен болады. Бір денеден екінші денеге энергияның берілуіне әкелетін микроскопиялық процестердің жиынтығы жылу берілуі деп аталады. Сонымен, жылу берілісі мен жұмыс, әрқашан да бір – біріне эквивалентті болады. Мысалы, сыртқы әсерлердің ықпалымен жүйе бір күйден екінші күйге көшетін болса, онда мұндай көшулердің мүмкін тәсілдерінің барлығында да сыртқы әсерлердің механикалық эквиваленттері қосындыс өзгермей тұрақты болып қалады. Сонда жүйе бір күйден екінші күйге көшкенде ішкі энергияның өзгерісі ∆U = Q – A Немесе Q = ∆U + A (6.9) Осы түрде жазылған өрнек термодинамиканың бірінші бастамасының математикалық теңдеуі болып табылады. Бұдан мынадай қорытынды шығады: жүйеге берілген жылу мөлшері жүйенің ішкі энергиясының өзгерісіне және жүйенің сыртқы денелерге қарсы істейтін жұмысына жұмсалады. Жүйенің істеген жұмысын немесе алған жылуын есептеген кезде қарстырылып отырған процесті әдетте әрқайсысы жүйе параметрлерінің аз ғана өзгеруіне сәйкес келетін бірнеше жай процестерге бөлуге тура келеді, сонда (51) теңдеу осындай процестер үшін мынадай түрде жазылады:
Мұндағы Жүйе энергиясы U оның күйінің функциясы болып табылатындықтан, dU толық дифференциал бола алмайды. Берілген жылу мөлшері мен жұмыс өзара эквивалентті болатындықтан, жылу мөлшері де жұмыс бірліктерімен, яғни джоульмен (Дж) өлшенеді. Егер жүйе өзінің бастапқы күйіне қайта оралса, оның энергиясы бұрыңғы мәніне ие болады, яғни тұйық жүйеде ішкі энергияның өзгерісі нольге тең dU = 0. Термодинамиканың бірінші бастамасына сәйкес: A = Q (6.11)
Газдың күйін сипаттайтын үш параметрдің (p, V, T) процесс кезінде әйтеуір біреуі тұрақты болып отырса, онда мұндай процестерді изопроцестер деп атайды. Олай болса, термодинамиканың көптеген мысалдарында: жылу двигательдерінің жұмысын есептеуде, суыту машиналарының жұмыс кезінде, қысқасы газдардағы процестер туралы көбірек айтуға болады. 1. Изохоралық процесс деп берілген газдың көлемі (V = const) тұрақты болғанда жүретін процесті айтамыз. Сонда ешқандай көлшем өзгерісі болмайды да (dV = 0) газ сыртқы күштерге қарсы жұмыс жасамайды.
Термодинамиканың бірінші бастамасы бойынша dQ = dU. (6.12) Ал тұрақты көлемдегі жылу сыйымдылық:
Яғни идеал газдың ішкі энергиясының өзгерісі оның абсолют температурасының өзгерісіне тура пропорционал болады. 2. Изобаралық процесс. Бұл процесс берілген газдың қысымы (p = const) тұрақты болғанда жүреді. Оның диаграммысн p – V координаттары арқылы кескіндеп көрсетуге болады (1 - сурет). сонда 1-2 кесіндісі газдың изобаралық ұлғаюын көрсетеді де, штрихталған аудан изобаралық жұмыстың шамасын анықтайды:
Мысалы, цилиндрдің ішінде ілгерілмелі еркін қозғалатын поршень мен цилиндрдің арасындағы газ қыздырудың немесе суынудың нәтижесінде изобаралық жұмыс жасайды. Термодинамиканың бірінші бастамсын ескеріп:
Мұндағы
3. Изотермалық процесс. Бұл процесс температура (T = const) тұрақты болғанда өтеді. Тұрақты температурада ∆U = 0 болғандықтан, термодинамика бірінші заңы:
Бұл процестің диаграммасы p, V координатындағы изотерма болып, оның түрі гипербола қисығына сәйкес келеді (2 - сурет). Берілген газдың көлемі
|

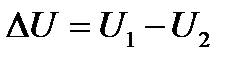 жүйенің алған жылу мөлшері Q мен сыртқы күштерге қарсы жасалатын жұмыстың (А) айырмасына тең:
жүйенің алған жылу мөлшері Q мен сыртқы күштерге қарсы жасалатын жұмыстың (А) айырмасына тең: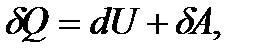 (6.10)
(6.10) - элементар жылу мөлшері,
- элементар жылу мөлшері,  - элементар жұмыс, dU – жүйенің ішкі энергиясының өсімшесі.
- элементар жұмыс, dU – жүйенің ішкі энергиясының өсімшесі. Термодинамиканың бірінші бастамасын изопроцестерге қолдану
Термодинамиканың бірінші бастамасын изопроцестерге қолдану


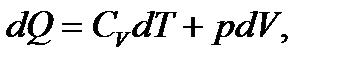 яғни
яғни 


 - изохоралық жылу сыйымдылығы. Сонымен, изобаралық процесс кезінде газға берілген жылу мөлшері оның шкі энергиясын арттыруға және сыртқы күштерге қарсы істелген жұмысқа жұмсалады. Бұл изобаралық процесс кезінде массасы m газға берілетін жылу мөлшері:
- изохоралық жылу сыйымдылығы. Сонымен, изобаралық процесс кезінде газға берілген жылу мөлшері оның шкі энергиясын арттыруға және сыртқы күштерге қарсы істелген жұмысқа жұмсалады. Бұл изобаралық процесс кезінде массасы m газға берілетін жылу мөлшері:  Оның ішкі энергиясының өзгерісі
Оның ішкі энергиясының өзгерісі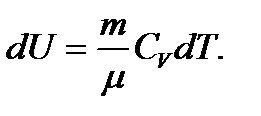
 түрінде жазылады, яғни жүйеге берілген жылу толығымен жұмыс жасауға кетеді.
түрінде жазылады, яғни жүйеге берілген жылу толығымен жұмыс жасауға кетеді.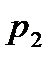




 - ге ұлғайғанда істелген жұмыс
- ге ұлғайғанда істелген жұмыс (6.14)
(6.14)


