Зависимость скорости от концентрации
Зависимость скорости от концентрации реагирующих веществ выражается законом действия масс (ЗДМ, закон Гульдберга и Вааге): скорость простых реакций (реакции, протекающие в одну стадию) прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, соответствующих стехиометрическим коэффициентам. Например, для обратимой реакции аА (г) + bВ (г)⇄ сС (г) + dD (г) ЗДМ имеет вид: υпр. = k 1×[ A ] а ×[ B ]b – для прямой реакции; υобр. = k 2×[ C ] c ×[ D ] d – для обратной реакции, где [ A ], [ B ], [ C ], [ D ] – молярные концентрации веществ, моль/л; a, b, c, d – стехиометрические коэффициенты; k 1, k 2 – константы скорости (скорости реакций при концентрациях веществ =1 моль/л). Для реакций, в которых участвуют твердые вещества, концентрации последних в выражение ЗДМ не включают (принято считать их равными единице). Например, для реакции NH3 (г)+ HCl (г)⇄ NH4Cl (тв.) ЗДМ: υ пр. = k 1×[NH3]×[ HCl], а υ обр. = k 2. Некоторые реакции характеризуются колебаниями концентраций промежуточных соединений и, соответственно, колебаниями скоростей превращений. Такие реакции называются колебательными. Примером может служить колебательное выделение газа при разложении пероксида водорода на металлической ртути. Поверхность ртутной капли в ходе реакции периодически покрывается оксидной пленкой, что вызывает изменение поверхностного натяжения, приводящее, в свою очередь, к изменению формы самой капли. Внешне это явление напоминает сердечные сокращения и названо поэтому “ртутным сердцем”. Механизмы колебательных реакций сложны, многие из них мало изучены. Описание этих реакций проводят, используя аппарат неравновесной термодинамики. 6.1.2.Зависимость скорости от температуры
При увеличении температуры скорость химической реакции увеличивается. Приближенно эта зависимость может быть определена с помощью правила Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2 – 4 раза:
где γ–температурный коэффициент, который меняется от 2 до 4; T 1, Т 2 – температура (Δ T должна быть всегда больше нуля, т.е. Т 2 > T 1); υ1 – скорость реакции при Т 1;υ2 – скорость реакции при Т 2. Более точно влияние температуры на скорость химической реакции можно определить с помощью уравнения Аррениуса:
где υ – скорость химической реакции, k – константа скорости (скоростьпри концентрациях реагентов, равных 1), А – предэкспоненциальный множитель, e – экспонента, R – газовая постоянная (8,31 Дж/моль×К), T – температура (К), Е а – энергия активации (кДж/моль). Значение предэкспоненциального множителя определяется природой реагентов, вступающих в реакцию.
где z – коэффициент, равный числу соударений молекул в 1 секунду для данной реакции; Р – стерический фактор, определяющий вероятность взаимодействия данных молекул. Величина энергии активации (Е а ) в уравнении Аррениуса имеет точное значение для каждой химической реакции и определяется природой реагирующих веществ. Энергия активации – избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества. Необходимо отметить, что энергия активации – это «избыточная» часть полной энергии системы. Молекулы, обладающие такой энергией, называются активными молекулами. Физический смысл энергии активации химической реакции можно продемонстрировать графиком изменения потенциальной энергии в ходе химической реакции (рис. 6.1.1).
Для того чтобы произошла реакция, необходимо сначала преодолеть отталкивание электронных оболочек молекул, разорвать или ослабить связи между атомами исходных веществ. На это надо затратить определенную энергию. Если энергия сталкивающихся молекул достаточна, то столкновение может привести к перестройке атомов и к образованию молекулы нового вещества. При разрыве или ослаблении связей между атомами в молекулах исходные вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом или переходным состоянием. Именно для его образования и необходима энергия активации (Е а). Неустойчивый активированный комплекс существует короткое время. Он распадается с образованием продуктов реакции или исходных веществ; при этом энергия выделяется. Переходное состояние возникает в ходе как прямой, так и обратной реакции. Энергетически оно отличается от исходных веществ на величину энергии активации прямой реакции, а от конечных – на энергию активации обратной реакции. Эти соотношения показаны на рис. 6.1.1; видно, что разность энергий активации прямой и обратной реакции равна тепловому эффекту реакции.
С ростом температуры наблюдается увеличение энергии системы и соответственно увеличивается доля молекул, энергия которых равна или превышает энергию активации данной химической реакции, что приводит к росту ее скорости. В зависимости от величины энергии активации выделяют реакции:
Энергию активации можно определить по экспериментальным данным, используя уравнение Аррениуса в логарифмическом виде (6.1.7). По экспериментальным данным строится график зависимости ln υ от 1/ Т (рис. 6.1.2.).
Предэкспоненциальный множитель определяется по отрезку b, отсекаемому экспериментальной прямой на оси ординат:
Энергия активации определяется по тангенсу угла наклона прямой:
где b – отрезок, отсекаемый экспериментальной прямой на оси ординат, a – отрезок, отсекаемый экспериментальной прямой на оси абсцисс (рис. 6.1.2). В ряде случаев частицы-реагенты могут получить энергию, необходимую для преодоления активационного барьера, в форме излучения. Химические реакции, инициируемые светом, называют фотохимическими. Эти реакции широко распространены в природе. Примером может служить фотосинтез. Фотохимические процессы являются разновидностью так называемых цепных реакций. Реакции этого типа характеризуются высокими скоростями и часто носят взрывной характер. Образование макроколичеств продукта реакции является результатом цепи элементарных (стадийных) взаимодействий. Цепная реакция отличается взаимосвязанностью всех промежуточных реакционных стадий. Выделяют три главные стадии: инициирование, развитие цепи и обрыв цепи. На первой стадии происходит образование активных частиц (радикалов), которые затем вступают во взаимодействие с частицами реагентов, образуя частицы продуктов реакции и новые радикалы. В случае фотохимических реакций радикалы образуются в результате действия фотонов. Высокая реакционная способность радикалов объясняется наличием у них неспаренных электронов. Обрыв цепи происходит в результате рекомбинации радикалов (взаимодействия их друг с другом). Если при каждом элементарном акте реакции каждый активный центр образует только один новый активный центр, цепная реакция называется неразветвленной. Если же каждый активный центр образует несколько новых активных центров, такую реакцию называют разветвленной цепной реакцией. Классическим примером цепной реакции является взаимодействие водорода с хлором под действием света: H2 + Cl2 + h ν = 2HCl. Действие света приводит к возбуждению молекулы хлора: Cl2 + h ν = 2Сl · – инициирование реакции. Образующиеся атомы хлора легко реагируют с молекулами водорода: Сl · + H2 = HCl.+ Н ·, а атомы водорода реагируют с атомами хлора: H · + Cl2 = HCl + Сl ·.
|

 или
или  ,
,
 ,
,


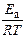 .
.
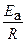 = tg(φ) =
= tg(φ) = 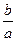 ;
;  ;
;



