Классификации растворов
Существует большое количество классификаций растворов. Ниже приведены наиболее распространенные из них. 1. По агрегатному состоянию растворы делят на жидкие, твердые и газообразные. Если растворитель и растворенное вещество находится в одном агрегатном состоянии, то растворителем считают тот компонент, которого больше. В соответствии с этой классификацией можно выделить следующие типы растворов: твердое вещество в жидкости; газ в жидкости; жидкость в жидкости; твердое в твердом (твердые растворы) и т.д 2. По размеру частиц (растворитель – жидкость, газ) растворы делят на коллоидные – если размеры частиц больше 1 нм и меньше 100 нм (например, молоко) и истинные – если размеры растворенного вещества меньше 1 нм = 10-9 м. Истинные растворы, в свою очередь делят на молекулярные (раствор сахара в воде) и ионные (раствор хлорида калия в воде). 3. По количеству компонентов растворенного вещества и растворителя: бинарные, тройные и т.д. 4. Важной характеристикой жидких растворов является проводимость (проводят ли электрический ток, содержат ли компоненты, которые способны переносить электричество). Это определяет многие свойства растворов, и, соответственно, дает нам ответ на вопрос какими законами необходимо пользоваться при описании раствора. С позиции проводимости растворы можно разделить на электролиты и неэлектролиты. Электролиты – вещества, растворы которых проводят электрический ток и растворенное вещество, преимущественно находится в виде ионов: АВ +nS⇄ АВ n S ⇄ А+xS + В–(n – x)S, где S – молекулы растворителя. Неэлектролиты – вещества, растворы которых не проводят электрический ток и растворимое вещество находится в виде молекул, т.е. не распадается на ионы. АВ + n S⇄ АВ n S Для характеристики процесса растворения твердого вещества в жидкости вводят величину коэффициента растворимости (растворимость) – количество вещества (г), растворяющееся в 100 г растворителя. Если коэффициент растворимостипри 25 ºСменее0,01, то вещество считается нерастворимым. Если коэффициент растворимости менее 1, но более 0,01, то вещество считается малорастворимым. Если коэффициент растворимости более 1, то вещество считается растворимым. Растворение твердого вещества в жидкости можно представить следующим уравнением: Втв. ⇄ Вр-р Если υ;пр> υ;обр, то преобладает процесс перехода твердого вещества в раствор. Такой раствор содержит растворенного вещества меньше, чем величина его растворимости и называется ненасыщенным. Если υ;пр< υ;обр, то преобладает процесс выпадения твердого вещества в осадок. Такой раствор содержит растворенного вещества больше, чем величина его растворимости и называется пересыщенным. Если υ;пр= υ;обр, то система находится в равновесии и такой раствор называется насыщенным. Растворимость вещества измеряется его содержанием в насыщенном растворе. Как и всякое физико-химическое равновесие, растворимость зависит от температуры. Таблица 7.1.1 Способы выражения концентраций растворов
Процесс растворимости состоит из двух стадий: разрушение кристаллической решетки твердого вещества и процесс взаимодействия растворителя с частицами растворенного вещества (сольватация). Разрушение кристаллической решетки процесс эндотермический (Δ RH > 0, Q < 0); а процесс сольватации экзотермический (Δ solvH < 0, Q > 0). Соответственно, в зависимости от того, изменении энтальпии какой реакции – разрушения кристалла или сольватации – имеет большее значение и будет определяться энтальпия реакции сольватации. Если | Δ RH | > | Δ solvH |, то процесс растворения является эндотермическим, и при повышении температуры растворимость будет увеличиваться. Например, Δ раств . Н 0298 (KNO3) = 35,6 кДж/моль. Если | Δ RH | < | Δ solvH |, то процесс растворения является экзотермическим, и при повышении температуры растворимость будет уменьшаться. Например, Δ раств . Н 0298 (КОН) = –55 кДж/моль. Основной характеристикой растворов является концентрация: это отношение количества растворенного вещества к массе или объему растворителя. В таблице 8.1.1. приведены наиболее распространенные способы выражения концентраций растворов. В современных лабораториях такие обозначения концентаций не применяют. Все концентрации обозначаются буквой С и отличаются друг от друга единицами измерения.
7.1.2. Коллигативные свойства растворов Коллигативные свойства растворов – свойства, не зависящие от природы растворенного вещества, а зависящие только от его концентрации. К ним относятся осмотическое давление, понижение давления насыщенного пара над раствором, понижение температуры кристаллизации и повышение температуры кипения растворов. Эти свойства описываются законами Рауля и законом осмоса. Если имеется некоторый объем жидкости, то над ней всегда присутствуют пары этой жидкости. При постоянных давлении и температуре эти пары находятся в динамическом равновесии с жидкостью. Если в чистый растворитель поместить некоторое количество растворенного вещества, то давление газа над жидкостью уменьшится. Эта зависимость описывается первым законом Рауля: относительное понижение давления насыщенного пара над раствором прямо пропорционально молярной доле растворенного вещества и обратно пропорционально молярной доле растворителя.
где P 0 – давление насыщенного пара растворителя; Р – давление насыщенного пара раствора, N – молярная доля. Второй закон Рауля: повышение температуры кипения раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации раствора
где E – эбуллиоскопическая константа, зависящая от природы растворителя (E Н2О = 0,52), Сm – моляльная концентрация раствора (моль/кг). Третий закон Рауля: понижение температуры замерзания раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации раствора
где К – криоскопическая константа, зависящая от природы растворителя (К Н2О = 1,86).
|





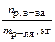 ;
; 


 ,
,
 ,
,
 ,
,



