Равновесие в гомогенных системах
Реакции могут быть необратимыми (идут до конца) и обратимыми (протекает в двух направлениях одновременно). Состояние обратимой реакции, при которой скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием. Например, для реакции аА (г) + bВ (г)⇄ сС (г) + dD (г) при υпр. = υобр.: k 1×[ A ] а ×[ B ] b = k 2×[ С ] а ×[ D ] d. После разделения переменных:
где КС – константа равновесия. Частное от деления произведения равновесных концентраций в степенях, равных стехиометрическим коэффициентам, продуктов реакции на произведение равновесных концентраций исходных веществ в соответствующих степенях является величиной постоянной при данной температуре и давлении и называется константой равновесия и обозначается символом К. В выражение для константы химического равновесия записывают только концентрации газообразных и растворенных веществ. Концентрации твердых веществ и чистых жидкостей считаются практически постоянными величинами. Для реакций с участием газообразных веществ константу равновесия более целесообразно выражать через парциальные давления газов (Р), а не через их концентрации. В этом случае константу равновесия обозначают символом КР. Например, для реакции 2Н2 (г) + О2 (г)⇄ 2Н2О(г), выражение для константы равновесия имеет вид:
Константа равновесия для реакции зависит от температуры и давления, но не зависит от концентрации реагирующих веществ. Присутствие катализатора также не влияет на константу равновесия, а только уменьшает время достижения равновесия. Численное значение константы равновесия характеризует выход продуктов реакции, чем больше константа равновесия, тем полнее выход продуктов. Она связана со стандартным изменением энергии Гиббса уравнением:
Из уравнения 6.2.3 следует, что при Химическое равновесие сохраняется, пока внешние условия сохраняются постоянными. Изменение условий вызывает смещение химического равновесия. Равновесие может быть нарушено вследствие изменения концентрации исходных веществ и продуктов реакции, изменения температуры и давления. Поведение системы в этом случае может быть описано принципом Ле Шателье: если на систему, находящуюся в равновесии оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, чтобы уменьшить оказанное воздействие: Условия смещения равновесия следующие: 1. Повышение температуры вызывает ускорение той реакции, протекание которой сопровождается поглощением тепла (эндотермическая реакция). Напротив, понижение температуры благоприятствует протеканию реакции, сопровождающейся выделением тепла (экзотермической реакции). 2. Повышение давления ускоряет ту реакцию, в которой происходит уменьшение количеств газообразных веществ, а понижение давления – реакцию, сопровождающуюся увеличением количеств газообразных веществ. 3. Добавление в реакционную систему какого-либо компонента смещает равновесие в сторону той реакции, где этот компонент расходуется. Отвод какого-либо вещества из реакционной системы, напротив, ускоряет реакцию, в которой это вещество образуется. Рассмотрим реакцию образования аммиака N2 (г)+ 3H2 (г)⇄ 2NH3 (г) При увеличении температуры система стремиться понизить ее. Поэтому равновесие сместится в сторону эндотермической реакции, т.е. влево При увеличении давления система будет стремиться понизить его. Равновесие сместиться вправо, так как в этом направлении уменьшается количество газообразных веществ: 1 моль N2 + 3 моля H2 (4 моля) ⇄ 2 моля NH3. При увеличении в системе концентрации азота и водорода система будет стремиться уменьшить содержание этих веществ и равновесие сместиться в сторону прямой реакции – образования аммиака (вправо). При увеличении концентрации аммиака равновесие сместится влево – в сторону образования азота и водорода. И наоборот, уменьшение содержания водорода и азота приведет к смещению равновесия влево; а отвод из системы аммиака приведет к смещению равновесия вправо.
|

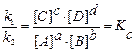 ,
,
 .
.
 .
.
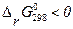 , КР > 1, а это означает, что продукты реакции преобладают над исходными веществами (т.е. возможно самопроизвольное протекание прямой реакции при стандартных условиях); при
, КР > 1, а это означает, что продукты реакции преобладают над исходными веществами (т.е. возможно самопроизвольное протекание прямой реакции при стандартных условиях); при  , КР < 1, следовательно, исходные вещества преобладают над продуктами реакции (т.е. возможно самопроизвольное протекание обратной реакции при стандартных условиях).
, КР < 1, следовательно, исходные вещества преобладают над продуктами реакции (т.е. возможно самопроизвольное протекание обратной реакции при стандартных условиях).



