Ионное произведение воды
Вода – очень слабый электролит, поэтому на ионы диссоциирует в незначительной степени: Н2О ⇄ Н++ ОН–. Для данного равновесия на основе закона действия масс, можно записать константу равновесия – константу диссоциации воды (КД):
Обозначая К д × [Н2О] через К В, получим: К В= [Н+]×[ОН–] К В– называют ионным произведением воды. При 25 °С К В= 1·10–14, тогда
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. В чистой воде при 25 оС [H+] = [ОН–] = 1·10–7моль/л Раствор, в котором концентрация ионов водорода равна концентрации гидроксид-ионов называют нейтральным. Если концентрация [Н+] > [ОН –], то такой раствор называют кислым. Если концентрация [Н+] < [ОН–], то раствор называют щелочным. Кислотность или щелочность раствора выражают другим более удобным способом: вместо концентраций ионов водорода [H+] и гидроксид-ионов используют их десятичный логарифм, взятый с обратным знаком:
Соответственно,
Величина рН называется водородным показателем и для характеристики среды раствора используется чаще: рН > 7 – среда щелочная; рН < 7 – среда кислая; рН ≈ 7 – среда нейтральная. При использовании величин концентраций часто наблюдается отклонение от закона действующих масс, в основном для сильных электролитов. Поэтому вместо концентраций пользуются активностями электролита (а). Отличие активности электролита от концентрации связано с частичной или полной диссоциацией его молекул на ионы, появлением сил электростатического взаимодействия этих ионов, взаимодействием ионов с молекулами растворителя. Активность связана с концентрацией через коэффициент активности (γ;):
Коэффициент активности – работа против сил, вызывающих отклонение свойств раствора от свойств идеальных растворов. Например, рН = – lg aH+. Установлено, что в малоконцентрированных растворахкоэффициент активности иона определяется только электростатическими взаимодействиями. Следовательно, γ зависит только от концентрации электролита и заряда иона и не зависит от природы электролита. Мерой электростатического взаимодействия является ионная сила раствора (I). Связь коэффициента активности электролита с ионной силой раствора описывает предельный закон Дебая-Хюккеля:
где А – коэффициент, зависящий от температуры и диэлектрической постоянной растворителя Для воды при 298К А = 0,509. Обычно для приближенных расчетов рассчитывают ионную силу раствора и на основании этого определяют коэффициент активности по справочным данным:
|

 или К д × [ Н2О] = [Н+] × [ ОН–].
или К д × [ Н2О] = [Н+] × [ ОН–]. ,
,
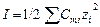 ,
,



