Гидролиз солей
Гидролизом соли называется процесс взаимодействия ионов соли с ионами воды с изменением рН среды. Обязательным условием гидролиза является образование малодиссоциированного вещества (слабого электролита). Качественно реакцию среды определяют с помощью индикаторов. Выделяют четыре типа реакций взаимодействия солей с водой: 1. Соль, образованная ионами сильного основания (катионами) и сильной кислоты (анионами), гидролизу не подвергается. Растворы таких солей имеют нейтральную среду рН ≈ 7. K2SO4 + H2O ≠ 2. Соль, образованная катионами сильного основания и анионами слабой (средней) кислоты, гидролизуется по аниону (рН раствора >7). KCN + H2O ⇄ KOH + HCN, ионное уравнение: K++ CN– + H2O ⇄ K++ OH–+ HCN, сокращенное ионное уравнение CN–+ H2O ⇄ OH–+ HCN. 3. Соль, образованная катионами слабого основания и анионами сильной кислоты, гидролизуется по катиону (рН < 7). NH4Cl + H2O ⇄ NH4OH + HCl, ионное уравнение NH4++ Cl–+ H2O ⇄ NH4OH + H++ Cl–, сокращенное ионное уравнение NH4++ H2O ⇄ NH4OH +H+. 4. Соль, образованная катионами слабого основания и анионами слабой кислоты, гидролизуется полностью до образования слабой кислоты и слабого основания (рН раствора ≈7). NH4CN + H2O → NH4ОН + HCN. Гидролиз солей, образованных многозарядными ионами протекает ступенчато. Например, гидролиз фосфата натрия протекает в три ступени: 1-я ступень: Na3PO4 + H2O ⇄ Na2HPO4 + NaOH; ионное уравнение: 3Na++PO43–+ H2O ⇄ 2Na++ HPO42–+ Na++ OH–; 2-я ступень Na2HPO4 + H2O ⇄ NaH2PO4+ NaOH; ионное уравнение 2Na++НPO42–+H2O ⇄ Na++ H2PO4–+ Na++OH–; 3-я ступень NaH2PO4+ H2O ⇄ H3PO4+ NaOH; ионное уравнение Na+ +Н2PO42- + H2O ⇄ H3PO4 + Na+ + OH–; Гидролиз хлорида меди протекает в две ступени: 1-я ступень CuCl2 + H2O ⇄ CuOHCl + HCl; ионное уравнение Cu2++ 2Cl–+ H2O ⇄ CuOH++ Cl–+ H++ Cl–; 2-я ступень: CuOHCl + H2O ⇄ Cu(OH)2 + HCl; ионное уравнение CuOH+ + Cl–+ H2O ⇄ Cu(OH)2 + H+ + Cl–. При комнатной температуре соли гидролизуются, как правило, только по 1 ступени, за исключением солей, образованных катионом слабого основания и анионом слабой кислоты. Количественно реакция гидролиза характеризуется степенью гидролиза b и константой гидролиза К Г. Степень гидролиза представляет отношение концентрации гидролизованных молекул к общей концентрации вещества. Степень гидролиза зависит от температуры и концентрации веществ. Константа равновесия реакции гидролиза называется константой гидролиза. Она связана со степенью гидролиза следующим уравнением:
Константа гидролиза связана с ионным произведением воды через константы диссоциации слабых электролитов:
В уравнениях (8.2.12 – 8.2.14) К ДО – константа диссоциации слабого основания, К ДК – константа диссоциации слабой кислоты.
|


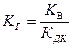 – гидролиз соли, образованной катионами сильного основания и анионами слабой (средней) кислоты;
– гидролиз соли, образованной катионами сильного основания и анионами слабой (средней) кислоты;
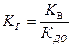 – гидролиз соли, образованной катионами слабого основания и анионами сильной кислоты;
– гидролиз соли, образованной катионами слабого основания и анионами сильной кислоты;
 – гидролиз соли, образованной катионами слабого основания и анионами слабой кислоты.
– гидролиз соли, образованной катионами слабого основания и анионами слабой кислоты.



