Закон осмоса
Диффузия – это процесс самопроизвольного перемешивания вещества в растворе, приводящий к выравниванию его концентрации в объеме. Осмос - это процесс диффузии молекул вещества через полупроницаемую мембрану, которая обладает свойством пропускать молекулы в одном направлении и не пропускать их при диффузии молекул в обратном направлении.В результате осмоса в системе возникает избыточное давление – осмотическое (π;). Его рассчитывают по закону Вант-Гоффа (закону осмоса):
где См – молярная концентрация раствора, R – газовая постоянная, Т – температура. Уравнения 8.1.1 – 8.1.4 применимы только к растворам неэлектролитов. Для растворов электролитов в уравнение вводят поправочный коэффициент Вант-Гоффа (i) – изотонический коэффициент.
Изотонический коэффициент связан со степенью диссоциации электролита
где ν; – количество ионов, образующихся при диссоциации одной молекулы. При большом разбавлении i равен числу ионов, на которые распадается электролит. Например, для раствора LiBr i =2, Na2SO4 – i = 3. 7.2 Свойства растворов электролитов
Распад электролита на ионы под влиянием полярных молекул растворителя (например, воды) называется электролитической диссоциацией. АВ + n+m Н2О ⇄ АВ (Н2О) n+m ⇄ А+(Н2О) n + В–(Н2О) m Сольватация – процесс взаимодействия молекул растворителя с частицами (ионами) растворенного вещества; частный случай сольватации – гидратация (если растворитель вода). А+n(Н2О) – гидратированный ион. Количественной характеристикой процесса диссоциации является степень электролитической диссоциации. Степень электролитической диссоциации (a) показывает отношение числа молекул диссоциирующих (распавшихся) на ионы, к общему числу молекул растворенного вещества.
Степень диссоциации можно представить также как отношение равновесной концентрации ионов, на которые диссоциировала молекула к начальной концентрации электролита:
Степень диссоциации зависит от природы растворенного вещества, природы растворителя, от температуры, от концентрации раствора. С повышением температуры степень диссоциации увеличивается, так как процесс распада молекул происходит с поглощением энергии. Описать влияние природы растворенного вещества на степень диссоциации можно следующим образом. Электролиты делятся на истинные и потенциальные. Истинные электролиты имеют преимущественно ионный тип связи, их растворы образуются в две стадии: растворение и диссоциация: КCl тв.+ (n + m)H2O ⇄K+ n (H2O)р-р+ Cl– m (H2O) р-р. Потенциальные электролиты имеют ковалентный полярный тип связи их растворы образуются в три стадии: растворение, ионизация и диссоциация: CdCl2 тв.+ (n + m)H2O ⇄ CdCl2(n + m)H2Oр-р⇄ ⇄ Cd2+ n (H2O)р-р+ 2Cl– m (H2O) р-р.
По величине степени диссоциации (a) электролиты подразделяются на слабые, средние и сильные (табл. 8.2.1). Таблица 8.2.1 Классификация электролитов (С = 0,01 М)
Сильные электролиты – это вещества, которые при растворении в воде практически полностью распадаются на ионы. В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют. В растворах сильных электролитов диссоциация необратима. Слабые электролиты – вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. В растворах слабых электролитов диссоциация обратима и существует равновесие между недиссоциированными молекулами и ионами: АВ ⇄ А+ + В–.
7.2.1. Равновесие в растворах электролитов
Равновесие между недиссоциированными молекулами и ионами описывается соответствующей константой, называемой константой диссоциации. Константа диссоциации (K д) – отношение произведения равновесных концентраций ионов в степени соответствующих стехиометрических коэффициентов к концентрации недиссоциированных молекул.
где [А+], [В-], [АВ] – равновесные молярные концентрации ионов и недиссоциированных частиц. Значения констант диссоциации слабых электролитов определены экспериментально и приведены в справочниках. Для сильных электролитов константы отсутствуют, т. к. их диссоциация необратима. Например, диссоциация уксусной кислоты и константа диссоциации выражаются уравнениями: CH3COOH ⇄ CH3COO–+ H+, Если молекула слабого электролита состоит более чем из двух ионов, то его диссоциация идет по ступеням, и каждая ступень характеризуется своей константой диссоциации. Например, диссоциация H2CO3 может протекать в 2 ступени: 1 ступень H2СO3 ⇄ H+ + HСO3–
2 ступень: HСO3–⇄ H++ СO32–
Исходя из значений константы диссоциации, можно оценивать и сравнивать силу электролитов: чем меньше К Д тем слабее электролит, и наоборот. Для разбавленных растворов слабых электролитов между константой диссоциации, концентрацией раствора и степенью диссоциации существует связь, которая выражается законом разбавления Оствальда: степень диссоциации возрастает с уменьшением концентрации раствора (т.е. при его разбавлении).
Если степень диссоциации очень мала a<<1, то (1–a)»1. Следовательно, закон разбавления Оствальда для слабых электролитов принимает вид:
|

 ,
Δ T кип = iECm
,
Δ T кип = iECm
 или
или 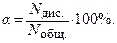
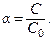
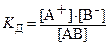 ,
,
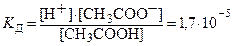 .
.


 или
или  .
.



