Газ тәріздес қоспаларды бөлудің негізгі үрдістері
Абсорбция. Газдарды сіңіру арқылы тазалау жайындағы жалпы мәліметтер. Сіңіру арқылы тазалау сұйықтардың газдарды ерітуі немесе химиялық әсерге түсуі арқылы жүреді. Ол кезде заттардың газ күйінен сұйыққа ауысуы жүреді немес үрдіс керісінше болады. Газ фазасындағы зат сұйық фазаға ауысады, оны абсорбциялық компонент дейді, немесе абсорибтивті деп атайды. Газ фазасынан сұйық фазаға өтпейтін заттар газ тасымалдаушы деп аталады. Сіңірілетін компоненттерді ерітетін зат абсорбент делінеді. Газ ағымының қалған бөліктерінің сіңіру компоненттерімен айырмасы оларды әдетте инертті газдар делінеді. Физикалық және химиялық жұтылуды (хемосорбция) ажырата білу керек. Физикалық жұтылу кезінде еріткіште жұтылу компонентінің физикалық тұрғыда ыдырауы жүреді. Бұл химиялық реакция арқылы өтпейді. Егер жұтылу газ фазасындағы жұтылу компонентінің порциальдық қысымы белгілі еріткіштің порциальдық қысымына үлкен жағдайында өтсе жұтылу үрдісі өтеді. Жұтылуда затты бірнеше қайталауда пайдалану үшін оны регенерация жасайды. Бұл кезде одан жұтылатын компонентті бөліп шығарады.
Сурет 4.9 - Газ сұйықтық шекарасы бөлігіндегі массаберу үрдісі сызбасы.
Химиялық түрде абсорбция кезінде абсорбцияланатын компонент сорбентпен химиялық реакцияға түседі. Ол кезде сұйық фазада жаңа химиялық қосылыстар пайда болады. Мұнда екі жағдай болады: қайтымды және қайтымсыз реакция жүреді. Хемосорбциондық үрдістер газ қоспасынан барлық компоненттері бөлінуін қамтамасыз етеді. Қайтымды хемосорбциялық үрдіс үстінде алынған жұтылу ерітінділердің регенерациясын физикалық абсорбция кезіндегі әдістермен үргізіледі. Ал қайтымсыз кері хемосорбция кезінде алынған абсорбция еріткіштерін регенерациялау химиялық тәсілдер арқылы жүргізіледі. Сұйықтықта еритін газ мөлшері газдар мен сұйықтықтардың қасиеттеріне байланысты келеді және оның еру жайына тәуелді: сұйықтық температурасы және газдың сұйықтыққа түсірген парциалдық қысымы әсер етеді. Абсорбция кезінде газ компоненті массасының сұйықтыққа берілуі жүреді. Абсорбция жүйесіндегі масса бөлу. Масса беру – күрделі үрдіс. Ол әр фазасынан заттарды тасымалдау және фаза шекара бөліктері арқылы зат тасымалдаудан тұрады (4.9. сурет). Газдардың турбулентті қозғалысы кезінде оның суландыру сұйықтығымен әсерлесу үстінде «Г»-«Ж» фазалары бөлігінде ламинарлы қабат пайда болады. Бұл қабаттар қозғалмалы емес. Мұндай жағдай заттардың шекаралық фазаларда кедергісі болмайды немесе тепе теңдік болады деп тұжырым жасауға әкеледі. Масса берудің теңдеуін
арқылы көрсетуге болады. Мұндағы, G- уақыт бірлігіне айналған зат массасы, кг/с; Газ фазасындағы қозғаушы күш әдетте парциалды қысым айырмасы Абсорбция кезінде парциалды қысымды р заттар газ фазасынан сұйыққа айналғанда с концентрациясы: G = βr F (p – pc) (4,50)
G = βж F (ср – с) (4,50)
түрінде болады, мұндағы, Фазалар теңдігі шартына орай беттегі түйісу
Pp = mp cp (4.52) Мұндағы, Идеал ерітінділер үшін Генри заңына бағынатын газдар ерігіштігінде фазалар теңдігі константы қоспалар мен температураға тәуелді келеді. Олар соңғысының үлкейе түсуінен бастап көтеріледі. Бұл кезде газ ерігіштігі азаяды, осыған байланысты жұтылу үрдісін өткізу үшін төменгі температура қажет.
Cурет 4.10 - Парциалды қысымның концентрацияға байланысы
Ерітінді жақсы араласқанда идеал қалыпқа жақындайды, ол Генри заңын қолдануға мүмкіндік береді. Сондықтан бұл заң нашар еритін газдардың тепе теңдік күйін сипаттауға қолайлы. Ал жоғарғы ерігіштік қасиеті бар газдар үшін ол салыстырмалы түрде төмегі концентрация үстінде ғана қолайлы; жоғарғы концентрацияда ерігіштігі әдетте төмен келеді. Оны Генри заңы да мақұлдайды. Бұл кезде көлем Барлық жағдайда фаза теңдігінің тұрақтылығы (константа) қысымға, температураға және сұйықтағы абсорбент қоспасына тәуелді. Кейбір жағдайларда оларды газдар мен сұйықтардың термодинамикалық қасиеттеріне қарап та анықтауға болады, бірақ көбінесе оларды тәжірибе жолымен анықтайды. Масса алу теңдеуін қайта құрғаннан кейін масса беру теңдеуі де шығады:
G = KM F (p – p*) (4.53)
Мұндағы, Масса беру коэффициенті абсорбердегі үрдістің өту жиілігін сипаттайды. Қозғаушы күш жұтылатын компоненттің бөліну деңгейін анықтап береді.
Мұндағы mi =
Осы тәріздес теңдеуді сұйықтың компоненттері құрамын салыстырған кезде қолдану мүмкін болады. Бұндай кезде фаза тепе теңдігінің
M2=
Мұндағы, Масса беру теңдеулерінде, оны масса алу теңдеуоерінен ажырататын қозғаушы күш. Ол абсорбция компоненті немесе сұйықтағы оның қоспасы ( 4.54 теңдеуінде Жалпы кедергілер болып саналатын әрбір жеке фаза кедергілерінің үлесі алдымен Газдарды жақсы, жаман немесе баяу еритін деп бөлу шартты түрдегі нәрсе. Сондықтан әр газ түрінің ерігіштігі көптеген факторларға тікелей байланысты. Алайда шартты түрде Жақсы еритін газдарға аммиакты ( Абсорбция үрдісін есептеу кезіндегі мәселеге үрдістің қозғаушы күші мен масса беру коэффициентін анықьау жатады. Бұл үшін аталған мәндер көлемін анықтауға арналған түрліше теорияларды да пайдалануға болады. Есептеу кезінде тасымалдау бірлігі сандарын есепке алады (қозғаушы күшке жақындау)
Мұндағы
Мұнда, H – қондырғы биіктігі, м. 4.57 теңдеуін сұйық фазада қолдануға болады. Тасымалдаушы бірлікті абсорбер элементі деп есептеуге болады. Жұтылу компоненті құрамының өзгеруі берілген элементтегі орташа қозғаушы күшке тең. Тасымалдаушы бірліктің биіктігі скруббер биіктігіне тең (екі бірлік те бірдей). Тасымалдаушы бірліктің санын анықтау үшін интегралды графикалық, графикалық тәсілдер мен сандық интегралдық әдіс қолданылады. Олар арнайы әдебиеттерде беріледі. Хемосорбция. Хемосорбция кезінде сұйық фазадағы абсорбция компонент қоспасы азаяды, ол қоспа құрамы заттарының молайуына және тұтылу үрдісінің жедел өтуіне себеп болады. Үрдіс жылдамдығы бұл кезде тек май алмасу жылдамдығына ғана тәуелді болмайды, сонымен қатар компоненттерінің химиялық әсерінің жылдамдығына да тән болады. Бұд арада екі түрлі жағдай болуы мүмкін: химиялық әсерлер жылдамдығының соңғы бөлігі үрдісті аяқтағанда (кинетикалық аймақ) немесе жұтылу компоненті диффузиясы әсер ететін жерге араласқанда (әсер аймағы). Сұйық фазадағы жұтылу жылдамдығы химиялық реакциялар әсерінен күрделенген кезде Ф үдеуі факторы қолданылады:
Мұндағы
«Ф» Адсорбция. Газдарды адсорбциялы тазалау жайлы жалпы мәліметтер. Газдалған фазадан жұтылған заттар адсорбция үрдісінде адсорбтив деп аталады, ал беттегі қатты заттар немесе заттар жұтылатын бет адсорбент деп аталады. Газдық фаза немесе шығарылатын компонент орны газ тасымалдаушы делінсе, ал бөлінген зат жұтылатын кезде адсорбат деп аталынады. Адсорбция құбылысы адсорбент молекулалары арасындағы тартылу күштері және түйісетін фаза бөлінісі шегінің болуымен сипатталады. Адсорбтив молекулаларының газ тасымалдаушыдан бөліну үрдісі адсорбенттің жоғарғы қабатында өткенде, адсорбент тартылу күші газ тасымалдаушы адсорбтив күшінен басымырақ болады. Қатты дененің кристалл торының сызбасын қарап көрелік (4.11. сурет). Кристалл ішінде орналасқан «А» атомының алты бірдей көрші атомдары бар. Олар бір
Cурет 4.11 - Адсорбенттің кристалл торының сызбасы.
Бұлардан басқа кристалдың қырларына орналасқан «В» атомының энергиясы бәрінен жоғары. Оның жақын төрт көрші атомы бар, осыдан келіп энергия артықшылығы пайда болады. Ең үлкен энергия кристалл төбесінде орналасқан «Г» атомында. Оның үш қана жақын көрші атомдары бар. Бұл үш бос байланысы бар деген сөз. Осы энергия артықшылығы «жоғарғы» деп аталады және адсорбцияға себеп болады. Адсорбтелген зат молекуласы адсорбент бетіне өткенде, оның энергиясын азайтады. Нәтижесінде жылу бөлінеді. Физикалық адсорбция жылуы үлкен емес және небәрі 60кДж/моль шамасында ғана болады. Адсорбент тартылу күші түрліше табиғи жағдайда: физикалық және химиялық болады. Осыған сәйкес физикалық және химиялық адсорбцияны ажыратады. Физикалық адсорбция кезінде молекулалардың адсорбент бетімен әсері әлсіз дисперстік, индукциялық және бағыт күштері әсерімен анықталады. Бұл кезде адсорбтелген молекулалар адсорбент молекулаларымен химиялық байланысқа түспейді, өзінің жеке қалпын сақтайды. Ал физикалық адсорбция үшін жоғары жылдамдық тән. Әлсіз байланыстың адсорбент пен адсорбті бет аралығында болуы және адсорбцияның әлсіз жылуы да оған тән болады. Температура өскен кезде физикалық тұрғыдан адсорбтелген заттар саны кемиді, ал қысымның көбеуі адсорбция көлемінің ұлғаюына әкеп соғады. Физикалық адсорбцияның артықшылығы – үрдістің тез кері қайтуы. Адсорбенттің газ қоспасындағы қысымы азайғанда немесе температура көтерілгенде адсорбтелген молекулалар химиялық құрмы өзгерместен –ақ десорбтеледі; ал регенерирленген адсорбентті бірнеше қайтара қолдануға болады. Физикалық адсорбция жылдамдығының жоғары болуы мен адсорбенттердің регенерацияға қабілеттілігі үрдісті қайтарымды жағдайда бөліп өткізуге қолайлы келеді немесе жұтылу кезеңдерін кезектеп және бөліну компоненттерін бөлу түрінде өткізуге болады. Химиялық адсорбция негізіне адсорбент пен адсорбтелетін заттар арасындағы химиялық байланыс жатады. Бұл кезде әсер ететін күштер саны көп болады. Физикалық адсорбцияға қарағанда бөлінген жылу химиялық реакция жылуымен сәйкес келеді. Ол 20-дан 400кДж/моль шамасында өзгеріп отырады. Мұндай адсорбция жылуының үлкен болуынан хемосорбирленген молекулаларының байланыс энергиясы осы молекулалардың газ ағымындағы байланыс энергиясынан айырмашылығы өте үлкен болады. Сондықтан хемосорбирленген молекула өзге сұрыпты молекулалардан бөлініп тұруы үшін энергиясы газ фазаларындағы молекулалар реакциясына қажет энергиядан аз болуы керек. Қатты дененің сыртқы беттегі адсорбирленген молекуласының өзге молекулалармен химиялық реакцияға жеңіл түсуі осылай түсіндіріледі. Химиялық адсорбцияның өзге де маңызды айырым белгісі болады: химиялық өзара байланысқа түскен адсорбтив молекуласы жоғарғы сыртқы бетте адсорбент кезінде де сақталады. Химиялық адсорбцияның басты ерекшелігіне оның жылдамдығының төменгі температурада төмен болуымен ол көтерілген сайын үлкейетіні де жатады. Газдар адсорбциясы бірнеше кезеңде өтеді. Бастапқы кезеңге газ молекуласының қатты дененің ішкі жағына өтуі жатады. Бұл кезең газ молекуласы диффузиясының стационар қабаты арқылы газ бөліктерінің шегі болатын – адсорбация кезіндегі сұйықтық та жатады. Екінші кезеңде газ молекулалары қатты денелерге кірігеді, ал үшінші кезеңде молекулалар адсорбциялануының белгілі аймаққа енуі болады. Адсорбция өзге екі кезеңге қарағанда өте тез өтеді. Газдарды тазартуда физикалық адсорбция үлкен мәнге ие. Адсорбция жылдамдығы. Адсорбция жылдамдығы адсорбтивтік диффузия жылдамдығымен анықталады. Ол адсорбент гранул беттері диффузиясына, не адсорбтив жылдамдығына немесе екі кезеңге де байланысты келеді. Адсорбтив диффузиясының адсорбенттің сыртқы бетіне өтуі газ тасымалдаушы жылдамдығына, температураға, газ тасымалдаушы адсорбтив диффузиясы коэфициентіне, ортаның тығыздығына тәуелді. Адсорбтивтің гранул ішіндегі жылдамдығы адсорбент грануласы өлшеміне, адсорбтив молекуласы өлшемдеріне, температураға және өзге де факторларға тәуелді. Адсорбция үрдісінің өтуі үрдістің мезгілмен немесе үздіксіз өтуіне тәуелді. Мезгілдік үрдістер адсорбенттің қозғалмайтын қабығына бастайды, ол үздіксіз үрдіс- қозғалмалы не қайнап жатқан қабыққа бағытталады. Температура көтерілсе, адсорбирленген заттар саны азаяды. Адсорбция үрдісі бұл жағдайда графика түрінде адсорбция изобарасы түрінде көрінеді (4.12. сурет). Ол адсорбирленген заттардың а санының өзгеруінің тұрақты қысым кезіндегі температураға тәуелділігін көрсетеді. Адсорбтив температура қысымының тұрақты температура кезінде көтерілуімен адсорбент белсенділігі көтеріледі. Бірақ бұл көтерілу белгілі бір кезге дейін ғана созылады. Ол адсорбенттің толығуымен немесе адсорбент жұтылу сыйымдылығының жоғарлап бітуімен сипатталады. Кез келген қатты дененің жоғарғы беті болады, сондықтан адсорбент пайда болады. Техникада әдетте сыртқы беті қатты дамыған адсорбенттер қолданылады. Оның пайда болуы олардың синтез үрдісі немесе арнайы өндеу жұмыстары кезінде жүзеге асады.
Cурет 4.12 - Адсорбция изобарасы.
Адсорбенттердің негізгі қасиетіне динамикалық сыйымдылық (қорғану әрекеттерінің уақыты) пен өлшемдері, адсорбенттердің белсенділігі жатады. Адсорбенттердің адсорбциялық сыйымдылығы. Адсорбенттердің статистикалық және динамикалық сыйымдылығын ажырата білу керек. Статистикалық сыйымдылық жүйенің тепе теңдік жағдайына сәйкес келеді. Ол адсорбенттердің тепе теңдік жағдайында қанша заттарды адсорбирлей алатынын көрсетеді немесе адсорбтив қоспасы шығу мен кіру кезінде бірдей болатынын байқатады. Адсорбенттің динамикалық сыйымдылығы адсорбция басталғаннан аяқталғанға дейін адсорбент қабатының денелерді жұту санына сәйкес немесе газ тасымалдаушыдан адсорбент қабаты шыққандағы адсорбтив іздері көрінумен айқындалады. Газ тасымалдаушының адсорбтив қоспасы әдетте грамның литрге, мольге, паскальдағы парциалдық қысымға немесе қаныққан бу Адсорбенттің адсорбциялық сыйымдылығы оның табиғатына қатысты. Ол бет үлкейсе үлкейеді, кеуіктенеді. Ал адсорбент қоспасы өлшемдері төмендесе немесе газ тасымалдаушыдағы адсорбтив қоспасы мен жүйедегі қысымға қатысты да көтеріледі. Сондықтан оларды пайдалану алдында кептіреді, ал десорбция үрдісін тура сондай температура мен қысымда өткізеді. Адсорбенттің ұзақ уақыт жұмыстан кейін өз белсенділігін жоғалтпауы және сонша денелерді адсорбтеуі маңызды. Жақсы адсорбенттер адсорбция десорбцияның жүздеген не мыңдаған циклдарын өз белсенділігін жоғалтпай-ақ өткізеді. Адсорбенттердің кеуекті құрылымы. Адсорбенттердің сыртқы беті каркас пішініне байланысты, одан кеуекті дене жасалады. Олардың ішкі және сыртқы түрлерінің айырмашылығы ьар. Сыртқы беті ірі денелер санына байланысты екледі. Олар үлкен емес, адсорбент бетінің 0,5-2 Адсорбенттер бөлшектер арасындағы бос кеңістіктерде пайда болған кеуікті денелердің каркасына байланысты болады. Бұл бөлшектер шар тәріздес, эллипс, цилиндр немесе талшық түрінде де болуы мүмкін. Қатты денелердің тұрқы радиусы 1000-2000 Ірі поралы адсорбент көлемді өлшемді молекулалы денелерді үлкен қысым үстінде жақсы ыдыратады. Орта кеуекті адсорбент орта қысымда тиімді ыдыратса, ұсақ кеуектілер – төменгі қысымда нәтижелі ыдыратады. Ұсақ пораларда адсорбция энергиясы өзге үлкен немесе құбылмалы пораларға қарағанда жоғары болады. Ол адсорбирленген молекула өлшемдері адсорбент порасы өлшемімен бірдей кезде екі қабырғасымен де өзара әрекеттеседі. Бұл кезде жылу көп бөлінеді (бір қабырға молекулалар адсорбциясы кезіне қарағанда). Ұсақ поралар адсорбенттерінің көлем шегі 0,2-0,6 Адсорбенттер таңдамалығы. Оған адсорбенттердің газ қоспасының ішінен физико-химиялық қасиеттері бар жекелеген заттарды ыдырату қабілеті жатады. Адсорбент таңдамасы олардың құрылымдық қасиеттеріне байланысты, өйткені поралар өлшемдерінен түрлі көлемдегі молекулаларды ыдыратуға тәуелді. Егер орташа радиус ыдырау молекуласы радиусынан кәдімгідей үлкен болса, онда олар молекулаларды тек жекелей түрде ғана ыдыратады. Тиімді ыдырату орташа радиус тура сондай тәртіппен орналасқан ыдырайтын молекулалар бар кезде ғана жүзеге асады.
|


 , (4.49)
, (4.49) масса беру коэфициенті. Ол зат массасы уақыт бірлігі ішіндегі қозғалмалы күштің қабатының көрсеткіші, кг/(
масса беру коэфициенті. Ол зат массасы уақыт бірлігі ішіндегі қозғалмалы күштің қабатының көрсеткіші, кг/( ), Ғ- фаза түйісуінің беті,
), Ғ- фаза түйісуінің беті,  ;
;  үрдістің қозғаушы күші.
үрдістің қозғаушы күші.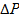 ретінде беріледі, ал сұйық ортада әдетте концентрация
ретінде беріледі, ал сұйық ортада әдетте концентрация  айырмашылығы түрінде көрінеді.
айырмашылығы түрінде көрінеді. газдалған және сұйық фаза кезіндегі масса бөлу коэффициенті;
газдалған және сұйық фаза кезіндегі масса бөлу коэффициенті;  шектік фазадағы жұтылу компонентінің парциалды қысымы, Па;
шектік фазадағы жұтылу компонентінің парциалды қысымы, Па;  фазаның шектік бөлінуінің жұтылатын концентрациясы, кг/
фазаның шектік бөлінуінің жұтылатын концентрациясы, кг/  .
. фаза теңдігі константы,
фаза теңдігі константы,  (4.10.сурет).
(4.10.сурет).
 жұтатын заттың құрамына тәуелді болады р және с параметрлерінің өзара байланысын сипаттайтын өзара тепе теңдік сызығы қисық түрде келеді.
жұтатын заттың құрамына тәуелді болады р және с параметрлерінің өзара байланысын сипаттайтын өзара тепе теңдік сызығы қисық түрде келеді. масса беру коэффициенті, с/м;
масса беру коэффициенті, с/м;  абсорбцияланатын компоненттің парциалдық қысымы, оның сұйықтағы қоспасының тепе теңдігі с, яғни
абсорбцияланатын компоненттің парциалдық қысымы, оның сұйықтағы қоспасының тепе теңдігі с, яғни  , Па.
, Па. көлемі мына теңдеумен сипатталады:
көлемі мына теңдеумен сипатталады: , (4.54)
, (4.54) фаза теңдігі тұрақтылығының орташа мәні. Ол мына формуламен анықталады:
фаза теңдігі тұрақтылығының орташа мәні. Ол мына формуламен анықталады: , (4.55)
, (4.55) констант мәні төмендегі формуламен анықталады:
констант мәні төмендегі формуламен анықталады: , (4.56)
, (4.56) сұйықтағы абсорбент компоненттерінің қоспасы, ол оның газ фазасындағы парциалды қысымының үлесіне тең, кг/
сұйықтағы абсорбент компоненттерінің қоспасы, ол оның газ фазасындағы парциалды қысымының үлесіне тең, кг/  түрінде болады.
түрінде болады. газ фазасындағы болатын масса беру кедергісі, ал 1/
газ фазасындағы болатын масса беру кедергісі, ал 1/  сұйық фазаның кедергісі. Бұл сандардың жиынтығы 1/
сұйық фазаның кедергісі. Бұл сандардың жиынтығы 1/  мәнінің көлемімен анықталады.
мәнінің көлемімен анықталады.  төмен келеді. Бұл кезде сұйық фазаның кедергісін есепке алмай
төмен келеді. Бұл кезде сұйық фазаның кедергісін есепке алмай  ақ
ақ  деп алуға болады.
деп алуға болады.  болып келеді.
болып келеді.  газдарды жақсы еритін,
газдарды жақсы еритін,  түріндегілерін нашар, ал
түріндегілерін нашар, ал 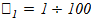 түрінде келетіндерін баяю еритін деп бөлуге болады.
түрінде келетіндерін баяю еритін деп бөлуге болады. , хлорды (келтірілген мәліметтер көрсетілген газдардың суда ерігіштігіне сай берілген) жатқызуға болады.
, хлорды (келтірілген мәліметтер көрсетілген газдардың суда ерігіштігіне сай берілген) жатқызуға болады. , (4.57)
, (4.57) жұтылатын компоненттің парциалды қысымы;
жұтылатын компоненттің парциалды қысымы;  үрдістің орташа қозғаушы күші. Сонымен қатар тасымалдаушы бірліктің биіктігі (масса беру коэффициенті тәрізді) де есептеледі:
үрдістің орташа қозғаушы күші. Сонымен қатар тасымалдаушы бірліктің биіктігі (масса беру коэффициенті тәрізді) де есептеледі: , (4.57)
, (4.57) төмен болған сайын абсорбция жылдам өтеді.
төмен болған сайын абсорбция жылдам өтеді. , (4.59)
, (4.59) сұйық фазадағы хемосорбция мен физикалық жұтылуға сәйкес масса беру коэффициенті
сұйық фазадағы хемосорбция мен физикалық жұтылуға сәйкес масса беру коэффициенті , (4.60)
, (4.60)

 қысымындағы парциалды қысымның қатынасымен анықталса, адсорбциялық сыйымдылық (белсенділік) жұтылған денелер грамының 100гр адсорбентке, не мольдің грамға, сантиметр кубтың грамға, масса пайызына, өзге де қосылыстарға қатысымен сипатталады.
қысымындағы парциалды қысымның қатынасымен анықталса, адсорбциялық сыйымдылық (белсенділік) жұтылған денелер грамының 100гр адсорбентке, не мольдің грамға, сантиметр кубтың грамға, масса пайызына, өзге де қосылыстарға қатысымен сипатталады. немесе 0,2-0,5% ғана құрайды. Ал ішкі беті ұсақ денелердің қабырғалары мен орта денелерден құралады да олардың көлемі мен өлшемдеріне байланысты келеді, 500-1000
немесе 0,2-0,5% ғана құрайды. Ал ішкі беті ұсақ денелердің қабырғалары мен орта денелерден құралады да олардың көлемі мен өлшемдеріне байланысты келеді, 500-1000  үлкен немесе радиусы 15
үлкен немесе радиусы 15  , сыртқы бөлігі 500
, сыртқы бөлігі 500  жетеді, кейде одан да басымырақ келеді. Осыған байланысты микропоралар газ қоспалары бөлінгенде басты қызмет атқарады. Ол әсіресе газдарды аз қоспалар қосындысынан тазалағанда байқалады.
жетеді, кейде одан да басымырақ келеді. Осыған байланысты микропоралар газ қоспалары бөлінгенде басты қызмет атқарады. Ол әсіресе газдарды аз қоспалар қосындысынан тазалағанда байқалады.


