САМОСТІЙНА АУДИТОРНА РОБОТА. Для роботи отримайте зразки дистилятів мінеральних отрут у чергового лаборанта або викладача
Для роботи отримайте зразки дистилятів мінеральних отрут у чергового лаборанта або викладача. Виконайте реакції виявлення їх: на сірчану кислоту в дистиляті застосовують реакції з хлоридом барію, ацетатом свинцю і родизонатом натрію. Реакція з ацетатом свинцю. До декількох крапель дистиляту додають 2-3 краплі 3%-го розчину ацетату свинцю. При наявності сірчаної кислоти випадає білий осад сульфату свинцю, який не розчиняється в азотній кислоті, але розчиняється в їдких лугах і в розчині ацетату амонію при нагріванні:
на азотну кислоту застосовують описані нижче реакції: Реакція з дифеніламіном заснована на окисленні дифеніламину азотною кислотою. При цьому спочатку утворюється безбарвний діфенілбензидин, який при подальшому окисленні перетворюється в сполуку, що має синє забарвлення.
Реакція з бруцином. На годинникове скло наносять кілька крапель дистиляту і додають 2 - 3 краплі 0,02%-го свіжоприготованого розчину бруцину в концентрованій сірчаній кислоті. При наявності азотної кислоти в досліджуваному розчині з'являється червоне забарвлення. Таке ж забарвлення з бруцином дають нітрити, перхлорати й деякі інші окислювачі. Фарбування шерсті. Концентрована азотна кислота забарвлює білі вовняні нитки в жовтий колір. Від додавання аміаку жовте забарвлення ниток переходить в оранжеве. Видалення нітритів з досліджуваних розчинів. Перераховані вище реакції з дифеніламіном і бруцином на азотну кислоту дає і азотиста кислота. Тому перед виконанням реакцій на азотну кислоту досліджуваний розчин перевіряють на наявність азотистої кислоти та її солей (гл. VII, § 7). При наявності азотистої кислоти її видаляють з розчину, а потім виконують реакції на азотну кислоту. Для видалення азотистої кислоти з розчинів використовують реакцію, яка заснована на розкладанні цієї кислоти сечовиною O = C (NH 2) 2, При цьому відбувається розкладання азотистої кислоти з виділенням азоту:
Припинення виділення газу свідчить про повне розкладанні азотистої кислоти. В отриманому розчині, що не містить азотистої кислоти, відкривають азотну кислоту за допомогою описаних вище реакцій.
на хлористоводневу (СОЛЯНу) кислоту: Реакція з нітратом срібла. До 1-2 мл дистиляту додають 1-2 краплі 5%-го розчину нітрату срібла і 1 мл розведеної азотної кислоти. Поява білого осаду хлориду срібла, який розчиняється в аміаку, вказує на наявність соляної кислоти в дистиляті. Реакція з хлоратом калію. До 1 мл дистиляту додають кілька кристаликів хлорату калію (КСlО 3) і нагрівають. При наявності соляної кислоти в дистиляті виділяється вільний хлор, який можна виявити за посинінням йод-крохмального папірця
На г ідроксид калію: Реакція з гідротартратом натрію. Гідротартрат натрію в нейтральних або оцтово-кислих розчинах з іонами калію дає білий кристалічний осад КНС4Н4О6. Цей осад розчиняється у гарячій воді, мінеральних кислотах і лугах. Потирання стінок пробірки скляною паличкою прискорює випадання осаду. Виконання реакції. У маленьку пробірку вносять 3-5 крапель досліджуваного діалізату, додають 3-4 краплі 1 н. розчину гідротартрату натрію або такий же об'єм суміші рівних кількостей 2 н. розчину винної кислоти і 2 н. розчину ацетату натрію. Стінки пробірки обережно потирають скляною паличкою. У присутності іонів калію випадає білий кристалічний осад. Реакції заважають іони амонію, які з гідротартрат натрію теж дають осад. Реакція з кобальтінітрітом натрію. Кобальтінітріт натрію Na 3 [Co (NO 2) 6] з нейтральних або слабокислих розчинів осаджує іони калію у вигляді жовтого кристалічного осаду K 2 Na [Co (NO 2) 6]. В сильнокислой середовищі відбувається розкладання реактиву з утворенням нестійкої кислоти Н 3 [З (] МО 2) 6], а в лужному середовищі при розкладанні реактиву утворюється осад Со (ОН) 3. Потирання стінок пробірки скляною паличкою прискорює випадання осаду. Реактив повинен бути свіжоприготованим. Виконання реакції. 3-5 крапель досліджуваного діалізату вносять в маленьку пробірку і додають 2-3 краплі розчину кобальтінітріта натрію. Випадання жовтого осаду вказує на наявність іонів калію в діалізаті. Реакції заважають іони амонію, іодіди і деякі відновники.
на гідроксид натрію: Реакція з гідроксостибіатом калію. Одним з реактивів на іони натрію є гідроксостибіат калію, якому в літературі приписується кілька формул: KSbO 3 • 3H 2 O, KH 2 SbO 4, K [Sb (OH) 6]. Цей реактив в нейтральній або слаболужному середовищі з іонами натрію дає білий кристалічний осад Na [Sb (OH) 6]. Осад гідроксостибіата (антимонату) натрію розчиняється у гарячій воді і в лугах. У кислому середовищі відбувається розкладання реактиву з утворенням аморфного осаду метасурьмяной кислоти HSbO 3. Випадання осаду метастибіатної кислоти може привести до помилкового висновку, так як осад HSbO 3 можна прийняти за осад Na [Sb (OH) 6]. Тому реакція з гідроксостибіатом калію на іони натрію повинна виконуватися в нейтральному середовищі. Лужні розчини нейтралізують оцтовою кислотою.Потирання стінок пробірки скляною паличкою прискорює випадання осаду. Виконання реакції. До 3-5 краплях діалізату, нейтралізованого оцтовою кислотою, додають 2-3 краплі розчину гідроксостібіата калію. Стінки пробірки потирають скляною паличкою. Випадання білого кристалічного осаду вказує на наявність іонів натрію у витяжці. При малій концентрації іонів натрію осад може з'явитися тільки через деякий час. Тому розчини, що містять малі кількості іонів натрію, попередньо концентрують упариванием. Реакції заважають іони амонію, магнію, літію та ін У присутності іонів амонію випадає осад НSbО 3, а в присутності іонів магнію і літію - білі опади антимонати цих іонів. Реакція з цинк-уранілацетатом. Уранілацетатом UO 2 (СН 3 СОО) 2 в нейтральних або оцтово-кислих розчинах з солями натрію дає зеленувато-жовтий кристалічний осад NaUO 2 (CH 3 COO) 3. Чутливість цієї реакції підвищується в присутності іонів цинку або магнію. Тому як реактиву на іони натрію застосовують розчин цинк-уранілацетатом Zn (UO 2) 3 (СН 3 COO) 8. Цей реактив з іонами натрію утворює кристалічний осад NaZn (UO 2) 3 (СН 3 СОО) 9. Виконання реакції. Реакцію на іони натрію можна виконувати в пробірці і на предметному склі. Для виконання цієї реакції застосовують діалізат, нейтралізований оцтової кислотою: 3-4 краплі діалізату вносять в пробірку, додають 8 - 10 крапель розчину цинк-уранілацетатом. Поява зеленувато-жовтого осаду вказує на наявність іонів натрію в діалізаті.
на аміак: перш ніж приступити до дослідження водних витяжок з біологічного матеріалу або діалізатом на наявність аміаку, хімік-експерт повинен перевірити ці рідини на присутність сірководню як одного з продуктів гниття білкових речовин. Виявлення сірководню в витяжках з біологічного матеріалу вказує на протікання процесів гниття досліджуваних об'єктів, в результаті чого утворюється як сірководень, так і аміак. Тому при наявності сірководню в біологічному матеріалі ці об'єкти на присутність аміаку не досліджують. На присутність аміаку піддають аналізу тільки ті органи трупів, які не піддалися гнильним змінам і не містять сірководню. Виявлення сірководню. 3-5 мл витяжки з біологічного матеріалу або діалізату вносять в колбу місткістю 50 мл, в яку додають 10%-й розчин соляної кислоти до кислої реакції на лакмус. Колбу відразу ж закривають пробкою, в прорізи на нижній поверхні якої вставлена смужка фільтрувального паперу, змочена розчином ацетату свинцю. При наявності сірководню утворюється сульфід свинцю, в результаті чого папір чорніє. Приготування папери, змоченою ацетатом свинцю (див. Додаток 1, реактив 5). Реакція з сульфатом міді і лакмусом. У колбу місткістю 50 мл вносять 10-15 мл водної витяжки з біологічного матеріалу або діалізату. Колбу закривають пробкою, на нижній поверхні якої в прорізи вставляють дві індикаторні папірці (волога червона лакмусовий папірець і папірець, змочений розчином сульфату міді). Посиніння лакмусового папірця і папірці, змоченою розчином сульфату міді (утворюється [Cu (NH 3) 4] SO 4), вказує на наявність аміаку у витяжці з біологічного матеріалу. Нагрівання колби на водяній бані прискорює зміна забарвлення індикаторних папірців. Реакція з реактивом Несслера. Від додавання реактиву Несслера до діалізату або лужної водної витяжки з біологічного матеріалу, що містить аміак, випадає осад иодида дііододімеркураммонія: Виконання реакції. В пробірку вносять 1-2 краплі досліджуваної витяжки або діалізату, додають 3-5 крапель води і 3-4 краплі реактиву Несслера. У присутності аміаку випадає жовто-бурий або оранжево-коричневий осад. Реакції заважають іони заліза (III) та інші іони, які з лугами дають опади, а також іони ртуті (II), сурми (III), олова (II), які реагують з іонами йоду і руйнують реактив Несслера.
На солі лужних металів: визначають наявність нітритів за допомогою реакцій з діазотованої сульфаніловою кислотою і з реактивом Грісса. Реакція з сульфаніловою кислотою і β-нафтолом. Після підкислення діалізатом, що містять нітрити, виділяється азотиста кислота HNO 2, яка з сульфаніловою кислотою (I) або з іншими первинними ароматичними амінами утворює сіль діазонію (II): При поєднанні отриманої солі діазонію з β-нафтолом (III) в лужному середовищі утворюється азокраситель (IV):Поєднання солей діазонію з фенолами і амінами відбувається в параположение по відношенню до фенольним чи амінів групам. Якщо параположение зайнято, то поєднання відбувається в орто-положенні. Виконання реакціі. В поглибленні на крапельної платівці або в маленьку пробірку вносять 1-2 краплі нейтралізованого діалізату, додають 2-3 краплі 0,5%-го розчину сульфанілової кислоти в 2%-й соляній кислоті. Після перемішування цих рідин через 3-5 хв додають краплю лужного розчину β-нафтолу. При наявності нітритів в досліджуваному розчині з'являється інтенсивна оранжево-червоне забарвлення. Інтенсівость забарвлення залежить від вмісту нітритів в пробі. Реакція з реактивом Грісса. Цей реактив складається з суль-фаніловой кислоти і α-нафтиламина. При взаємодії реактиву Грісса з нітритами утворюється азобарвник: Виконання реакції. У поглиблення на крапельної платівці або в маленьку пробірку вносять кілька крапель нейтралізованого діалізату, а потім додають 3-4 краплі реактиву Грісса. При наявності нітритів у водній витяжці відразу або через деякий час з'являється інтенсивна червоне забарвлення. Інтенсивність забарвлення залежить від кількості нітритів в пробі. Про наявність нітритів в діалізатах свідчить поява яскраво виражених забарвлень при зазначених вище реакціях. Якщо при реакції з сульфаниловою кислотою і з реактивом Грісса з'являється слабоінтенсивне забарвлення, то виникає питання про можливу появу забарвлень не за рахунок нітритів, що викликали отруєння, а за рахунок наявності їх у навколишньому середовищі.В цих випадках проводять відгонку нітритів з діалізатом в струмі оксиду вуглецю (IV). Частину діалізату вносять в колбу місткістю 50 мл і підкисляють оцтовою кислотою, яка з нітритів витісняє азотисту кислоту і не витісняє азотну кислоту з нітратів. Після підкислення діалізату з апарату кіп через колбу пропускають струм оксиду вуглецю (IV), який переносить азотисту кислоту або її ангідрид в приймач, що містить 1%-й розчин гідроксиду натрію. Після відгону азотистої кислоти вміст приймача нейтралізують 10%-м розчином соляної або оцтової кислоти (не допускаючи надлишку цих кислот), а потім в нейтралізованім дистиляті визначають наявність нітритів за допомогою описаних вище реакцій з реактивом Грісса, з сульфаниловою кислотою і β-нафтолом, а також за допомогою реакції фарбування йод-крохмального папірця. Виявлення нітритів за допомогою йод-крохмального папірця. При позитивних реакціях дистиляту з сульфаниловою кислотою, реактивом Грісса і йод-крохмальним папірцем роблять висновок про наявність нітритів в біологічному матеріалі. Для вирішення питання про склад нітритів, виявлених за допомогою зазначених вище реакцій, проводять реакції на катіони натрію і калію. З цією метою беруть діалізат і поступають так, як зазначено вище.
|

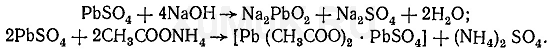
 :
:
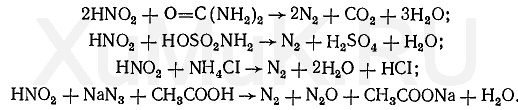
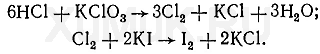 :
:


