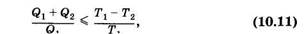Второе начало термодинамики. Энтропия
Первое начало термодинамики, являющееся, по существу, выражением закона сохранения энергии, не указывает направления возможного протекания процессов. Так, например, по первому началу термодинамики, при теплообмене одинаково возможным был бы как самопроизвольный переход теплоты от тела более нагретого к телу менее нагретому, так и, наоборот, от тела менее нагретого к телу более нагретому. Из повседневного опыта, однако, хорошо известно, что второй процесс в природе нереален; так, например, не может самопроизвольно нагреться вода в чайнике вследствие охлаждения воздуха в комнате. Другой пример: при падении камня на землю происходит его нагревание, эквивалентное изменению потенциальной энергии, обратный процесс — самопроизвольное поднятие камня только из-за его охлаждения — невозможен. Второе начало термодинамики, так же как и первое, является обобщением данных опыта. Существует несколько формулировок второго закона термодинамики: теплота самопроизвольно не может переходить от тела с меньшей температурой к телу с большей температурой (формулировка Клаузиуса), или невозможен вечный двигатель второго рода (формулировка Томсона), т. е. невозможен такой периодический процесс, единственным результатом которого было бы превращение теплоты в работу вследствие
охлаждения тела. В тепловой машине совершается работа за счет переданной теплоты, но при этом часть теплоты обязательно передается холодильнику. На рис. 10.4 схематически показаны соответственно невозможный (а) и возможный (б), по второму началу, периодические процессы. Рассмотрим некоторые термодинамические понятия, которые позволяют количественно выразить второе начало термодинамики. Процесс 1 —2 называют обратимым, если можно совершить обратный процесс 2—1 через все промежуточные состояния так, чтобы после возвращения системы в исходное состояние в окружающих телах не произошло каких-либо изменений. Обратимый процесс является физической абстракцией. Все реальные процессы необратимы хотя бы из-за наличия силы трения, которая вызывает нагревание окружающих тел. Некоторые характерные примеры необратимых процессов: расширение газа в пустоту, диффузия, теплообмен и т. д. Для возвращения системы в начальное состояние во всех этих случаях необходимо совершение работы внешними телами. Циклом или круговым процессом называют процесс, при котором система возвращается в исходное состояние.
отдает часть этой теплоты другому телу — теплоприемнику (холодильнику) (рис. 10.4, б). В этом цикле рабочее вещество (газ) в целом совершает положительную работу (рис. 10.5): в процессе 1—а—2 газ расширяется, работа положительна и численно равна площади под кривой 1—а—2; в процессе 2—б—1 работа отрицательна (сжатие газа) и численно равна площади под соответствующей кривой. Алгебраическое суммирование дает в целом положительную работу, совершенную газом за цикл. Она численно равна площади, ограниченной замкнутой кривой 1—а—2—б—1. Коэффициентом полезного действия тепловой машины или прямого цикла называют отношение совершенной работы к количеству теплоты, полученному рабочим веществом от нагревателя:
Так как работа тепловой машины совершается за счет количества теплоты, а внутренняя энергия рабочего вещества за цикл не изменяется (AU = 0), то из первого закона термодинамики следует, что работа в круговых процессах равна алгебраической сумме количеств теплоты: A = QX + Q2. Следовательно,
Количество теплоты Qv полученное рабочим веществом, положительно, количество теплоты Q2, отданное рабочим веществом холодильнику, отрицательно.
Рассмотрим цикл Карно (рис. 10.7), т. е. круговой процесс, состоящий из двух изотерм 1—2, 3—4, которым соответствуют температуры Т1 и Т2 (Т1 > Т2), и двух адиабат 2—3, 4—1. В этом цикле рабочим веществом является идеальный газ. Передача количества теплоты от нагревателя рабочему веществу происходит при температуре T1 а от рабочего вещества к холодильнику — при температуре Т2. Без доказательства укажем, что КПД обратимого цикла Карно зависит только от температур Т1 и Т2 нагревателя и холодильника:
Карно, исходя из второго начала термодинамики, доказал следующие положения: КПД всех обратимых машин, работающих по циклу, состоящему из двух изотерм и двух адиабат, с нагревателем при температуре Тг и холодильником при температуре Т2, равны между собой и не зависят от рабочего вещества и конструкции машины, совершающей цикл; КПД необратимой машины меньше КПД обратимой машины. Эти положения на основании (10.9) и (10.10) можно записать в виде
где знак «=» относится к обратимому циклу, а знак «<» — к необратимому. Это выражение представляет собой количественную формулировку второго начала. Покажем, что ее следствием являются обе качественные формулировки, приведенные в начале параграфа. Допустим, что происходит теплообмен между двумя телами без совершения работы, т. е. Ql + Q2 = 0. Тогда [см. (10.11)] Т1 - Т2 > 0 и T1 > T2, что соответствует формулировке Клаузиуса: в самопроизвольном процессе теплота передается от тел с более высокой температурой к телам с более низкой. В том случае, если тепловая машина полностью затрачивает всю полученную при теплообмене энергию на совершение работы и не отдает энергию холодильнику, Q2 = 0 и из (10.11) имеем
что невозможно, так как Т1 и Т2 положительны. Отсюда следует формулировка Томсона о невозможности вечного двигателя второго рода. Преобразуем выражение (10.11):
Отношение количества теплоты, полученного или отданного рабочим веществом, к температуре, при которой происходит теплообмен, называют приведенным количеством теплоты. Поэтому (10.12) можно сформулировать так алгебраическая сумма приведенных количеств теплоты за цикл не больше нуля (в обратимых циклах равна нулю, в необратимых — меньше нуля). Если состояние системы изменяется не по циклу Карно, а по некоторому произвольному циклу, то его можно представить в виде совокупности достаточно малых циклов Карно (рис. 10.8). Тогда выражение (10.12) преобразуется в сумму достаточно малых приведенных количеств теплоты, что в пределе выразится интегралом
Выражение (10.13) справедливо для любого необратимого (знак «<») или обратимого (знак «=») цикла; dQ/T — элементарная приведенная теплота. Кружок на знаке интеграла означает, что интегрирование проводится по замкнутому контуру, т. е. по циклу. 1 Рассмотрим обратимый цикл (см. рис. 10.5), состоящий из двух процессов аи б. Для него справедливо равенство:
На основе (10.13) для обратимых циклов имеем
Изменив пределы интегрирования по пути б, получим
Последнее означает, что сумма приведенных количеств теплоты цри обратимом переходе системы из одного состояния в другое не зависит от процесса, а для данной массы газа определяется только начальным и конечным состояниями системы. На рис. 10.9 показаны графики различных обратимых процессов (а, б, в), общими для которых являются начальное 1 и конечное 2 состояния. Количество теплоты и работа в этих процессах различны, но сумма приведенных количеств теплоты оказывается одинаковой. Физическую характеристику, не зависящую от процесса или перемещения, обычно выражают как разность двух значений некоторой функции, соответствующих конечному и начальному состояниям процесса или положениям системы. Так, например, независимость работы силы тяжести от траектории позволяет выразить эту работу через разность потенциальных энергий в конечных точках траектории; независимость работы сил электростатического поля от траекторий заряда позволяет связать эту работу с разностью потенциалов точек поля, являющихся граничными при его перемещении.
Аналогично, сумму приведенных количеств теплоты для обратимого процесса можно представить как разность двух значений некоторой функции состояния системы, которую называют энтропией:
где S2 и S1 — энтропия соответственно в конечном 2 и начальном 1 состояниях. Итак, энтропия есть функция состояния системы, разность значений которой для двух состояний равна сумме приведенных количеств теплоты при обратимом переходе системы из одного состояния в другое.
Если процесс необратим, то равенство (10.15) не выполняется. Пусть дан цикл (рис. 10.10), состоящий из обратимого 2—б—1 и необратимого 1—а—2 процессов. Так как часть цикла необратима, то и весь цикл необратим, поэтому на основании (10.13) запишем
Согласно (10.15), тогда вместо (10.16) получим, или
Итак, в необратимом процессе сумма приведенных количеств теплоты меньше изменения энтропии. Объединяя правые части (10.15) и (10.17), получаем
где знак «=» относится к обратимым, а знак «>» — к необратимым процессам. Соотношение (10.18) получено на основании (10.11) и поэтому также выражает второе начало термодинамики. Установим физический смысл энтропии. Формула (10.15) дает только разность энтропии, сама же энтропия определяется с точностью до произвольной постоянной:
Если система перешла из одного состояния в другое, то независимо от характера процесса — обратимый он или необратимый — изменение энтропии вычисляется по формуле (10.15) для любого обратимого процесса, происходящего между этими состояниями. Это обусловлено тем, что энтропия является функцией состояния системы. Разность энтропии двух состояний легко вычисляется в обратимом изотермическом процессе:
где Q — полное количество теплоты, полученное системой в процессе перехода из состояния 1 в состояние 2 при постоянной температуре Т. Последнюю формулу используют при вычислении изменения энтропии в таких процессах, как плавление, парообразование и т. п. В этих случаях Q — теплота фазового превращения. Если процесс происходит в изолированной системе (dQ = 0), то [см. (10.18)] в обратимом процессе энтропия не изменяется: S2 — S1 = 0, S = const, а в необратимом — возрастает. Это можно проиллюстрировать на примере теплообмена между двумя телами, образующими изолированную систему и имеющими температуру Т1 и Т2 соответственно (Т1 > Т2). Если небольшое количество теплоты dQ переходит от первого тела ко второму, то при этом энтропия первого тела уменьшается на dS1 = dQ/T1, а второго — увеличивается на dS2 = dQ/T2. Так как количество теплоты невелико, то можно считать, что температуры первого и второго тел в процессе теплообмена не изменяются. Полное изменение энтропии системы положительно:
следовательно, энтропия изолированной системы возрастает. Если бы в этой системе происходил самопроизвольный переход теплоты от тела с меньшей температурой к телу с большей температурой, то энтропия системы при этом уменьшилась бы:
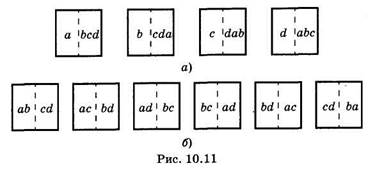
а это противоречит (10.18). Таким образом, в изолированной системе не могут протекать такие процессы, которые приводят к уменьшению энтропии системы (еще одна формулировка второго начала термодинамики). Увеличение энтропии в изолированной системе не будет происходить беспредельно. В рассмотренном выше примере температуры тел со временем выровняются, теплопередача между ними прекратится и наступит равновесное состояние (см. § 10.1). В этом состоянии параметры системы будут оставаться неизменными, а энтропия достигнет максимума. Согласно молекулярно-кинетической теории, энтропию наиболее удачно можно охарактеризовать как меру неупорядоченности расположения частиц системы. Так, например, при уменьшении объема газа его молекулы вынуждены занимать все более определенные положения одна относительно другой, что соответствует большему порядку в системе, при этом энтропия убывает. Когда газ конденсируется или жидкость кристаллизуется при постоянной температуре, то выделяется теплота, энтропия убывает. И в этом случае происходит увеличение порядка в расположении частиц. Неупорядоченность состояния системы количественно характеризуется термодинамической вероятностью Wтep. Для выяснения ее смысла рассмотрим систему, состоящую из четырех частиц газа: а, Ь, с, d (рис. 10.11). Эти частицы находятся в объеме, разделенном мысленно на две равные ячейки, и могут свободно в нем перемещаться. Состояние системы, определяемое числом частиц в первой и второй ячейках, назовем макросостоянием; состояние системы, определяемое тем, какие конкретно частицы находятся в каждой из ячеек, — микросостоянием. Тогда (рис. 10.11, а) макросостояние — одна частица в первой ячейке и три частицы во второй — осуществляется четырьмя микросостояниями. Макросостояние, соответствующее размещению четырех частиц равномерно по две в каждой ячейке, осуществляется шестью микросостояниями (рис. 10.11,6). Термодинамической вероятностью называют число способов размещения частиц или число микросостояний, реализующих данное макросостояние. В рассмотренных примерах Wтep = 4 в первом случае и Wтep = 6 во втором. Очевидно, что равномерному распределению частиц по ячейкам (по две) соответствует большая термодинамическая вероятность. С другой стороны, равномерное распределение частиц отвечает равновесному состоянию с наибольшей энтропией. Из теории вероятностей ясно, что система, предоставленная самой себе, стремится прийти к макросостоянию, которое реализуется наибольшим количеством способов, наибольшим количеством микросостояний, т. е. к состоянию с наибольшей термодинамической вероятностью.
Заметим, что если газу предоставить возможность расширяться, его молекулы будут стремиться равномерно занять весь возможный объем, при этом процессе энтропия увеличивается. Обратный процесс — стремление молекул занять лишь часть объема, например половину комнаты, — не наблюдается, этому соответствовало бы состояние со значительно меньшей термодинамической вероятностью и меньшей энтропией.
Отсюда можно сделать вывод о связи энтропии с термодинамической вероятностью. Больцман установил, что энтропия линейно связана с логарифмом термодинамической вероятности: где k — постоянная Больцмана. Второе начало термодинамики — статистический закон, в отличие, например, от первого начала термодинамики или второго закона Ньютона. Утверждение второго начала о невозможности некоторых процессов, по существу, является утверждением о чрезвычайно малой вероятности их, практически — невероятности, т. е. невозможности. В космических масштабах наблюдаются существенные отклонения от второго начала термодинамики, а ко всей Вселенной, так же, как и к системам, состоящим из малого числа молекул, оно неприменимо. В заключение еще раз отметим, что если первый закон термодинамики содержит энергетический баланс процесса, то второй закон показывает его возможное направление. Аналогично тому, как второй закон термодинамики существенно дополняет первый закон, так и энтропия дополняет понятие энергии.
|


 График цикла представляет собой замкнутую линию. Цикл, изображенный на рис. 10.5, — прямой, он соответствует тепловой машине, т. е. устройству, которое получает количество теплоты от некоторого тела — теплоотдатчика (нагревателя), совершает работу и
График цикла представляет собой замкнутую линию. Цикл, изображенный на рис. 10.5, — прямой, он соответствует тепловой машине, т. е. устройству, которое получает количество теплоты от некоторого тела — теплоотдатчика (нагревателя), совершает работу и

 Обратный цикл[2][2][2] соответствует работе холодильной машины, т. е. такой системе, которая отбирает теплоту от холодильника и передает большее количество теплоты нагревателю. Как следует из второго закона термодинамики, этот процесс (рис. 10.6) не может протекать сам собой, он происходит за счет работы внешних тел. При этом газ совершает отрицательную работу: работа сжатия в процессе 2—а—1 отрицательна, работа. В результате алгебраического расширения в процессе 1—6—2 положительна. В результате суммирования получаем отрицательную работу газа, численно равную площади, ограниченной кривой 2—а—1 —б—2.
Обратный цикл[2][2][2] соответствует работе холодильной машины, т. е. такой системе, которая отбирает теплоту от холодильника и передает большее количество теплоты нагревателю. Как следует из второго закона термодинамики, этот процесс (рис. 10.6) не может протекать сам собой, он происходит за счет работы внешних тел. При этом газ совершает отрицательную работу: работа сжатия в процессе 2—а—1 отрицательна, работа. В результате алгебраического расширения в процессе 1—6—2 положительна. В результате суммирования получаем отрицательную работу газа, численно равную площади, ограниченной кривой 2—а—1 —б—2.