Механизм реакции
I стадия. Поляризация молекулы галогена по действием π-связи алкена
Н2С = СН2 Br → Br π и образование электрофила Е+
Br → Br → Br+ + Br – гетеролиз Е+ II стадия. Образование π-комплекса за счет вакантной орбитали электрофила и пары электронов в π-связи
Br+
IV стадия. Присоединение Br – к карбкатиону, образование продукта реакции
Присоединение HНal или H2O к несимметричным алкенам (R – CH=CH2) идет по правилу Марковникова В.В.: Н присоединяется к наиболее, а Hal (или ОН–) к наименее гидрогенизированному атому С.
Пример 2. Присоединение бромоводорода к пропену
2–бромпропан
↑ē плотность, АЕ к пропену идет легче, чем с СН2=СН2 Механизм реакции (АЕ): I стадия: Гетеролиз связи в реагенте, образование электрофила (Е+).
E+ II стадия: Образование π-комплекса за счет вакантной орбитали электрофила и пары электрона π-связи.
III стадия: Образование σ–комплекса (карбкатиона), причем новая σ–связь образуется между Е+ и атомом С с δ–.
IV стадия: Присоединение Br – к карбкатиону, образование продукта реакции
катализатор Е+ π-комплекс σ–комплекс вода
катализатора ион оксония пропанол–2, конечный продукт реакции АЕ in vivo: гидратация непредельных соединений, идет с участием биокатализаторов (ферментов).
фумаровая кислота яблочная кислота Механизм реакции электрофильного замещения (SЕ) SЕ in vitro: галогенирование, нитрование, сульфирование, алкилирование, ацилирование ароматических соединений (бензола, его гомологов и производных). I стадия: Генерирование электрофильной частицы.
гетеролиз связи электрофил
+
в π-системе осталось 4 ē, ароматичность нарушена => σ–комплекс неустойчив.
Н+ + Х– = НХ Таблица 1. Образование электрофилов в реакциях SЕ.
Таблица 2.
|

 σ δ+ δ–
σ δ+ δ– δ+ δ–
δ+ δ– СН2 СН2
СН2 СН2 III стадия. Образование σ–комплекса (карбкатиона)
III стадия. Образование σ–комплекса (карбкатиона)
 R–CH=CH2 + HHal → R–CH–CH3
R–CH=CH2 + HHal → R–CH–CH3 R–CH=CH2 + H–ОН → R–CH–CH3
R–CH=CH2 + H–ОН → R–CH–CH3 Схема реакции:
Схема реакции:

 δ+ δ–
δ+ δ–
 H → Br → H+ + Br –
H → Br → H+ + Br – δ+ δ–
δ+ δ– CH3 → CH CH2
CH3 → CH CH2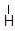 СН3 – СН+ – СН2
СН3 – СН+ – СН2
 Присоединение Н2О (гидратация) к алкенам идет с участием кислого катализатора (Н+ кислоты играет роль Е+).
Присоединение Н2О (гидратация) к алкенам идет с участием кислого катализатора (Н+ кислоты играет роль Е+).

 СН3 – СН – СН3 → СН3 – СН – СН3
СН3 – СН – СН3 → СН3 – СН – СН3 –Н+- регенерация
–Н+- регенерация

 фермент
фермент




 Е – Х → Еδ+ – Х δ– → Е+ + Х–
Е – Х → Еδ+ – Х δ– → Е+ + Х– II стадия: Образование π-комплекса: вся система π-связей кольца взаимодействует с электрофилом.
II стадия: Образование π-комплекса: вся система π-связей кольца взаимодействует с электрофилом.

 III стадия: Образование σ–комплекса: электрофил вытягивает из 6 ē π-системы кольца 2 электрона и образует новую σ–связь с одним из атомов С кольца.
III стадия: Образование σ–комплекса: электрофил вытягивает из 6 ē π-системы кольца 2 электрона и образует новую σ–связь с одним из атомов С кольца.
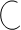

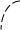
 + – Н+
+ – Н+ Название реакции
Название реакции
 Галогенирование
Галогенирование
 Нитрование
Нитрование
 Сульфирование
Сульфирование
 Алкилирование
Алкилирование





