Электролиз
Электролиз – это совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую энергию. Электролиз проводят в электролизере, который представляет собой емкость, заполненную раствором или расплавом электролита, в который погружены два электрода (например, графитовые) – катод и анод. Катод подсоединяют к отрицательному полюсу внешнего источника тока, а анод – к положительному. Таким образом, катод – отрицательно заряженный электрод, а анод – положительно заряженный электрод. На катоде происходит процесс присоединения электронов катода (от внешнего источника тока) катионами, атомами, молекулами. На аноде происходит процесс отдачи электронов аноду (во внешнюю цепь) анионами, атомами, молекулами. Таким образом, на катоде протекает процесс восстановления, на аноде – процесс окисления. Рассмотрим механизм электролиза на примере расплава соли фторида натрия NaF. Расплавы солей являются сильными электролитами, поэтому при высоких температурах полностью диссоциируют на ионы в соответствии с уравнением процесса: Под действием электрического тока ионы приобретают направленное движение: катионы будут двигаться к катоду, а анионы – к аноду. Достигнув электродов, ионы начнут разряжаться на их поверхности. На катоде будет происходить процесс (К–): Na+ + e → Na0 2 – процесс восстановления (A+): 2F- – 2e → F2 1 – процесс окисления 2Na+ + 2F- → Na0 + F2↑; Суммарное молекулярное уравнение электролиза:
Электролиз водных растворов электролитов осложняется участием в электродных процессах молекул воды. Алгоритм рассмотрения электролиза водных растворов солей приведен в примерах решения задач. При электролизе водных растворов электролитов необходимо учитывать особенности катодных и анодных процессов: 1. Катионы металлов от Li+ до Al3+ включительно (Е0Меn+/Ме0 < – 1,66 В) не восстанавливаются на катоде, вместо них на катоде восстанавливаются молекулы воды в соответствии с уравнением реакции: 2Н2О + 2е– = Н2 + 2ОН– 2. Катионы металлов от Mn2+ до H, восстанавливаются на катоде вместе с молекулами воды: Меn+ + ne– = Me0; 2Н2О + 2е– = Н2 + 2ОН– 3. Катионы металлов от Cu2+ до Au3+ полностью восстанавливаются на катоде в соответствии с уравнением реакции: Меn+ + ne– Me0 Если водный раствор электролита содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения значений стандартных электродных потенциалов металлов. 4. На практике используют два типа анодов: инертные или нерастворимые (уголь, графит, золото, платина) и активные или растворимые (Cu, Ag, Ni, Zn и др). Инертные электроды не участвуют в процессе электролиза. Активные аноды сами участвуют (окисляются) в процессе электролиза в соответствии с уравнением реакции: 5. Анионы кислородсодержащих кислот (SO42-, NO3-, CO32-, PO43 -), в которых центральный атом (S+6, N+5, C+4, P+5).находится в высшей степени окисления, а также ионы F– никогда не окисляется на аноде из водных растворов электролитов. Вместо них окисляются молекулы воды: 2Н2О – 4е– = О20 + 4Н+ Количественные соотношения между массой выделившихся на электродах веществ и количеством прошедшего электричества через раствор или расплав электролита выражают законом Фарадея:
где m – масса вещества, выделившегося на электроде; Э – его химический эквивалент; Q – количество электричества (Кл); F – число Фарадея (F= 96500 Кл). Q = I·t, где I – сила тока (А), t – время электролиза (с). Э=А/n, где А – атомная масса элемента; n – степень окисления его в соединении. Тогда выражение (31) примет вид:
При электролизе в реальных условиях масса выделившегося вещества (его практический выход) всегда меньше массы вещества, рассчитанной по закону Фарадея. Это объясняется тем, что наряду с основными электродными процессами протекают побочные процессы, на которые расходуется часть количества электричества. Поэтому вводится понятие «выход по току»: Впт =mпр/mтеор×100%, (33) где mпр – масса вещества, практически полученного в процессе электролиза; mтеор - масса вещества, теоретически рассчитанная по закону Фарадея.
|

 восстановления ионов Na+, а на аноде – процесс окисления ионов F–. Запишем электронные уравнения этих процессов и просуммируем их:
восстановления ионов Na+, а на аноде – процесс окисления ионов F–. Запишем электронные уравнения этих процессов и просуммируем их:
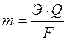 , (32)
, (32)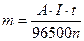 (33)
(33)


