ТЕОРЕТИЧЕСКАЯ ЧАСТЬ. Эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять или выделять один ион водорода в кислотно-основных реакциях (или
НАХОЖДЕНИЕ ЭКВИВАЛЕНТА ВЕЩЕСТВА
Цель работы – ознакомление с понятием эквивалент вещества и методикой расчета молярной массы эквивалентов по закону эквивалентов.
Эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять или выделять один ион водорода в кислотно-основных реакциях (или один электрон в окислительно-восстановительных реакциях). Единицей количества эквивалентов является моль. Моль эквивалентов – это количество вещества, содержащего 6,02×1023 эквивалентов. Масса моль эквивалентов называется молярной массой эквивалентов (МЭ) и выражаетсяв г/моль. Для расчета молярной массы эквивалента можно использовать формулы:
1) для элемента где МА – молярная масса атомов данного элемента; В - валентность атома
2) для сложного вещества где М – молярная масса данного элемента; В - валентность функциональной группы; n – число функциональных групп в молекуле. Для кислот функциональной группой является ион водорода, для оснований – гидроксид-ион, для солей – ион металла. Например,
Эквивалент может быть равен единице или быть меньше единицы. Используя определение молярной массы эквивалента, можно сформулировать закон эквивалентов: массы участвующих в реакции веществ пропорциональны молярным массам их эквивалентов.
Приборы и реактивы:прибор для измерения объема водорода, кислота соляная (W = 20%), цинк гранулированный. Сущность опыта заключается в определении объема водорода, выделившегося при взаимодействии цинка с кислотой и расчете эквивалентной массы цинка по закону эквивалентов. Описание работы: Определение эквивалентной массы цинка по объему вытесненного водорода осуществляется на лабораторной установке (рис.1). Установка состоит из двух бюреток: рабочей измерительной Б1 и уравнительной Б2, соединенных резиновой трубкой Т и заполненных подкрашенной водой. К рабочей бюретке при помощи газоотводной трубки Г присоединена пробирка П. Перед началом выполнения опыта необходимо проверить герметичность установки. Для этого пробирку плотно надеть на пробку газоотводной трубки, после чего уравнительную бюретку поднять или опустить на 15-20 см, закрепить ее в этом положении лапками штатива и наблюдать в течение 1-2 минут за положением в ней уровня жидкости. Если за это время уровень воды не изменится, это будет означать, что прибор герметичен, и можно приступать к выполнению работы. Для удобства отсчета объема выделившегося водорода перед началом работы жидкость в измерительной бюретке установить на нулевую отметку (по нижнему мениску). В пробирку П налить 5-6 мл 20% -ой соляной или серной кислоты, опустить в пробирку навеску металла и быстро надеть пробирку на пробку с газоотводной трубкой, не нарушая герметичности прибора. 2HCl+Zn=ZnCl2+H2↑ Когда весь металл растворится и прекратится выделение водорода, дать пробирке остыть 1-2 минуты, и не снимая пробирки, привести положение жидкости в измерительной и уравнительной бюретке к одному уровню, для чего уравнительную бюретку опустить вниз. Отметить объем выделившегося водорода в мл в измерительной бюретке от нулевой отметки до уровня жидкости (по нижнему мениску).
|

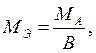
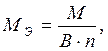

 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ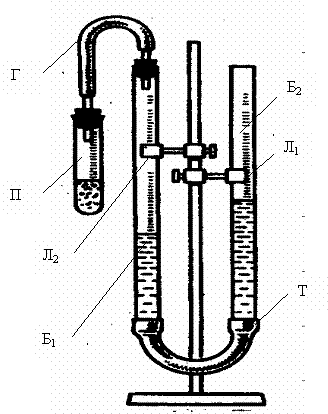
 Рис.1.Лабораторная установка для определения эквивалентной массы металла.
Рис.1.Лабораторная установка для определения эквивалентной массы металла.


