Постулаты Бора
Первый шаг на пути разрешения противоречий между теорией и результатами эксперимента в физике атома был сделан датским физиком Нильсом Бором (1885-1962). Свои представления об особых свойствах атомов Бор сформулировал в виде постулатов следующего содержания: 1. Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарном состояние атом не излучает. 2. При переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения. Энергия фотона равна разности энергий атома в двух стационарных состояниях. Все стационарные состояния, кроме одного, являются стационарными лишь условно. Бесконечно долго каждый атом может находиться лишь в стационарном состоянии с минимальным запасом энергии. Это состояние атома называется основным. Все остальные стационарные состояния атома называются возбужденными. В результате соударения с другим атомом, с заряженной частицей или при поглощении фотона атом может перейти из стационарного состояния с меньшим запасом энергии в стационарное состояние с большим запасом энергии. Из любого возбужденного состояния атом самопроизвольно может переходить в основное состояние; этот переход сопровождается излучением фотонов. Время жизни атомов в возбужденных состояниях обычно не превышает 10-8 — 10-7 с. Основное изменение, внесенное в физику атома постулатами Бора, заключалось в отказе от представлений о непрерывности изменения всех физических величин и в принятии идеи квантования физических величин, которыми описывается внутреннее состояние атома. Вместо непрерывного изменения расстояний между ядром и электроном в атоме оказывается возможным только дискретный ряд значений таких расстояний. Дискретными оказываются возможные значения кинетической и потенциальной энергии электрона в атоме, скорости его движения по круговой орбите. Бо́ровская моде́ль а́тома (Моде́ль Бо́ра) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно, и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка[1]: Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты
Здесь Именно такое выражение для энергии можно получить, применяя уравнение Шрёдингера, решая задачу о движении электрона в центральном кулоновском поле. Радиус первой орбиты в атоме водорода R0=5,2917720859(36)·10−11 м[2], ныне называется боровским радиусом, либо атомной единицей длины и широко используется в современной физике. Энергия первой орбиты
|

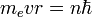 .
.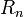 и энергии
и энергии 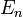 находящегося на этой орбите электрона:
находящегося на этой орбите электрона: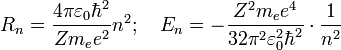
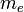 — масса электрона, Z — количество протонов в ядре,
— масса электрона, Z — количество протонов в ядре, 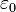 — диэлектрическая постоянная, e — заряд электрона.
— диэлектрическая постоянная, e — заряд электрона.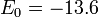 эВ представляет собойэнергию ионизации атома водорода.
эВ представляет собойэнергию ионизации атома водорода.


