Приготування еталонного розчину.
Еталонний розчин Ni 2+ використовують для добавок до досліджуваних розчинів. Еталонний розчин у має містити 0,1 мг Ni 2+ в 1 мл розчину. Розраховують необхідну кількість хімічно чистого хлориду для приготування еталонного розчину Ni 2+ з Т=0,1 мг/мл. На аналітичній вазі зважують розраховану кількість нікель хлориду. Кількісно переносять наважку в мірну колбу на 100 мл, розчиняють в невеликій кількості 0,5 н. розчину HNO3 і доводять 0,5 н HNO3 до мітки.
5.1.2. Приготування стандартних розчинів з добавкою і визначення їх оптичної густини. Одержаний від викладача розчин з невідомою концентрацією нікелю розводять в мірній колбі на 50 мл дистильованою водою до мітки і добре перемішують. Піпеткою відбирають по 2 мл виданого викладачем досліджуваного розчину, і вміщують в три мірні колби місткістю 50 мл. Готують два стандартні розчини: у другу колбу приливають 0,5 мл еталонного розчину, в третю – 1,0 мл еталонного розчину. Далі в кожну із трьох колб приливають по 2,5 мл розчинів диметилгліоксиму, лугу і свіжоприготовленого персульфату амонію. Дають постояти 2-3 хв, заповнюють колби дистильованою водою до мітки і ретельно перемішують. Через 5 хв з допомогою фотоелектроколориметра визначають оптичні густини для кожного розчину 4 рази, знаходять середнє значення і дані вносять в таблицю. Розчин порівняння – дистильована вода. Товщина поглинаючого шару – 5 см.
5.2. Визначення вмісту Ni 2+ . 5.2.1. Спосіб 1. Для визначення концентрації Ni 2+ Сх в досліджуваному розчині використовуються формули:
де Сх – невідома концентрація феруму (ІІІ) в досліджуваному забарвленому розчині; Сд – концентрація добавки в досліджуваному розчині (з розрахунку тільки доданого об’єму еталонного розчину). Сд зв’язана з концентрацією еталонного розчину добавки (Сет.) співвідношенням
де Vд – об’єм розчину добавки, Vх+д – об’єм забарвленого досліджуваного розчину з добавкою (місткість мірної колби), мл.
5.2.2. Спосіб 2. Одержані дані оптичної густини наносять на калібрувальний графік для визначення концентрації речовини методом добавок графічним способом (рис.1) і визначають концентрацію досліджуваного розчину.
5.2.3. Вміст нікелю Ni2+ в мг (mx) в розчині розраховують з врахуванням розбавлення:
де Vх — об’єм забарвленого досліджуваного розчину без добавки, мл; Vзаг — загальний об’єм досліджуваного розчину, мл; V1 — об’єм аліквотної частини досліджуваного розчину, взятої для приготування забарвленого розчину, мл; Сх – знайдена концентрація феруму (ІІІ) в досліджуваному забарвленому розчині, мг/мл. 5.3. Статистична обробка результатів аналізу. Визначіть інтервал надійності значень визначуваної величини і відносну похибку середнього результату даного методу.
Мета всіх аналітичних досліджень – знаходження результатів, найбільш близьких до істинного вмісту речовини у пробі. Загальну похибку методу можна оцінити з допомогою статистичної обробки результатів. При проведенні кількісного аналізу важливе місце належить його відтворюваності і правильності (достовірності), які тісно пов’язані з метрологічними параметрами хімічних реакцій, аналітичних приладів і вимірювачів. Відтворюваність аналізу – це якість аналізу, яка відображає близькість один до одного одержаних результатів аналіз, зумовлюється випадковими похибками. Правильність визначення відображає ступінь близькості одержаного результату аналізу до дійсного значення, наприклад, істинного вмісту речовини в аналізованому зразку, зумовлюється систематичними похибками. Для статистичної обробки необхідно визначити ряд метрологічних характеристик: - середнє арифметичне хс.; - стандартне відхилення результатів S – цей критерій найчастіше використовують для оцінки відтворюваності методу аналізу, характеризує розсіювання результатів відносно середнього
де di = хс. – хi; - інтервал надійності значень визначуваної величини або довірчий інтервал – інтервал, в якому з заданою довірчою ймовірністю α знаходиться істинне значення визначуваної величини – знаходять як хс.±ε
ε – похибка середнього результату аналізу;
α; – довірча ймовірність, відповідність експериментального значення істинній величині. В аналітичній практиці зазвичай її приймають за 0,95; (n -1) – число ступенів свободи експерименту (число паралельних вимірювань мінус одиниця). - відносну похибку середнього результату (правильність результатів аналізу):
За табличним даними при n = 4 і α; = 0,95 критерій Стьюдента КОНТРОЛЬНІ ЗАПИТАННЯ 1. Вимоги до реакцій, які використовуються в фотометричному аналізі для утворення забарвлених розчинів. 2. Що означає властивість адитивності оптичної густини? 3. Від яких факторів залежить оптична густина, молярний коефіцієнт поглинання? Дія яких факторів може призвести до порушення лінійної залежності оптичної густини від концентрації розчину? 4. Суть методу добавок. Як розраховується концентрація визначуваної речовини цим методом з допомогою графіка? 5. Суть методу різницевої фотометрії. 6. При визначенні титану методом добавок наважку сталі массою 0,5 г розчинили, об'єм розчину довели до 50,0 мл. Потім аліквоти розчину по 20,0 мл відібрали у дві мірні колби на 50 мл. В одну з них додали наважку солі титану, що містить 0,0010 г Ti. В обидві колби додали пероксид водню та об’єми довели до мітки. Обчислити відсотковий вміст титану в сталі, якщо при фотометруванні розчинів отримані наступні результати: Dx =0,22, Dx+ет.= 0,44.
ЛІТЕРАТУРА 1. Бабко А.К., Пилипенко А.Т. Колориметрический анализ. М., 1951. 2. Пешкова В.М., Громова М.И., Методы абсорбционной спектроскопии в аналитической химии. - М., 1976. 3. Барковский В.Ф., Горелик С.М., Городенцева Т.Б. Физико – химические методы анализа. - М., 1972. 4. Алесковский В.Р., Бардин В.В. Физико-химические методы анализа. Практическое руководство. - Л., Химия. 1988. 5. Петрухин О. М. Практикум по физико – химическим методам анализа. - М., Химия. 1987. 6. Основы аналитической химии. Практическое руководство. /Под ред. Ю.А.Золотова. - М., Высшая школа. 2001.
|


 (1)
(1) (2)
(2)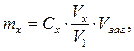 (3)
(3)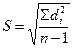 ,
,
 – критерій Стьюдента, який знаходять за таблицями для вибраних значень α; і (n -1);
– критерій Стьюдента, який знаходять за таблицями для вибраних значень α; і (n -1);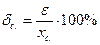 .
.


