Лаб. раб. 6. Коррозия металлов и защита от коррозии. 1. В каком из контактов: а) Fe/Ni; б) Ag/Fe; в) Cu/Fe скорость коррозии больше?
1. В каком из контактов: а) Fe/Ni; б) Ag/Fe; в) Cu/Fe скорость коррозии больше? Ответ подтвердите расчётами. 2. В контакте с каким из указанных металлов Fe является катодом: Zn, Cr, Sn? 3. Составьте схему работы (катодный и анодный процессы) гальванопары Cu/Cd в кислой среде.
Задание к лабораторным работам Вариант 6
Лаб. раб. 1. Основные классы неорганических соединений 1. Назовите по систематической номенклатуре следующие вещества: AgBr, KClO, KMnO4, KAl(SO4)2. 2. Масса 15 л газа при н.у. составляет 30,8 г. Рассчитать молярную массу газа. 3. Рассчитать объем 10 молей водорода при 500С и 80000 Па. 4. Рассчитать объем воздуха при н.у., необходимый для сжигания 1 м3 топливного газа, содержащего метан и пропан (по 50% об.). 5. Определить массу серы, которую можно получить из 200 кг пирита FeS2, содержащего 15% пустой породы.
Лаб. раб. 2. Определение энтальпии реакции 1. Вычислите ΔH ΔH0обр, кДж/моль -825 -110 0 -394 2. Рассчитайте энтальпию образования (ΔH 3. Укажите знак ΔH0 в процессах: а) Ca - 2e- → Ca+2; б) Са + 0,5О2 → СаО; в) Ca(к) → Ca(ж).
Лаб. раб. 3. Скорость химических реакций. Химическое равновесие 1. Выразите математически скорости прямой и обратной реакций, протекающих в гомогенной системе: HCl + O2 ↔ H2O + Cl2. 2. Выразите математически скорости прямой и обратной реакций, протекающих в гетерогенной системе: As2S3(к) + O2 ↔ As2O3(к) + SО2(г). 3. Напишите формулу для вычисления константы равновесия реакции: CaCO3(к) ↔ CaO(к) + CO2(г). 4. Как сместится равновесие обратимой реакции: C2H6 + O2 ↔ H2O + СО2при повышении давления?
|

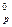 реакции: Fe3O4(к) + 4CO(г) ↔ 3Fe(к) + 4CO2(г), если
реакции: Fe3O4(к) + 4CO(г) ↔ 3Fe(к) + 4CO2(г), если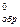 ) C2H2, если при образовании 52 г его поглощается 454 кДж.
) C2H2, если при образовании 52 г его поглощается 454 кДж.


