Лаб. раб. 3. Скорость химических реакций. Химическое равновесие
Задание к лабораторным работам Вариант 1
Лаб. раб. 1. Основные классы неорганических соединений 1. Назовите по систематической номенклатуре следующие вещества: O2, Fe2O3, Ca(OH)2, H2SO4. 2. Рассчитать объем 20 кг аммиака (NH3) при н.у. 3. Рассчитать объем, который занимает 150 г аммиака (NH3) при 330 мм.рт.ст. и 470С. 4. Рассчитать объем воздуха, необходимый для сжигания 1 кг 96 %-ного спирта (C2H5OH). 5. Определить массу карбамида NH2CONH2, которая потребуется чтобы внести в почву 70 кг азота.
Лаб. раб. 2. Определение энтальпии реакции 1. Вычислите ΔH ΔH0обр, кДж/моль -220 0 -102 -297 2. Рассчитайте энтальпию образования (ΔH 3. Укажите знак ΔH в процессах: а) горение бензола; б) расщепление углеводородов; в) нейтрализация серной кислоты гидроксидом натрия.
Лаб. раб. 3. Скорость химических реакций. Химическое равновесие 1. Выразите математически скорости прямой и обратной реакций, протекающих в гомогенной системе: NO + O2 ↔ NO2. 2. Выразите математически скорости прямой и обратной реакций, протекающих в гетерогенной системе: H2O(г) + Al(к) ↔ Al2O3(к) + H2(г). 3. Напишите формулу для вычисления константы равновесия реакции: N2(г) + H2(г) ↔ NH3(г). 4. В каком направлении будет смещаться равновесие обратимой реакции: CaCO3 ↔ CaO + CO2 при повышении температуры?
|

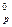 в реакции: 2PbS(к) + 3O2(г) ↔ 2PbO(к) + 2SO2(г), если
в реакции: 2PbS(к) + 3O2(г) ↔ 2PbO(к) + 2SO2(г), если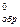 ) NH3, если при образовании 34 г выделилось 92 кДж тепла.
) NH3, если при образовании 34 г выделилось 92 кДж тепла.


