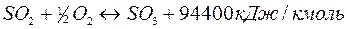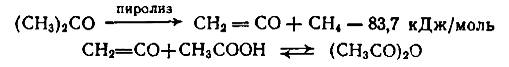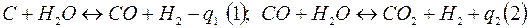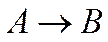Методические рекомендации по выполнению контрольной работы по дисциплине
Составитель – Тимакин Олег Анатольевич (toa555@mail.ru)
Самарский государственный технический университет
Кафедра «Химическая технология и промышленная экология»
ЗАДАНИЕ на контрольную работу по дисциплине «Общая химическая технология»
Студенту: факультета ЗФ курса III группы
ВАРИАНТ №
Контрольная работа по дисциплине «Общая химическая технология» включает в себя три теоретических вопроса и три задачи согласно варианту. Теоретические вопросы, приведенные ниже, предназначены также и для подготовки к экзамену. Для ответа на них следует использовать литературу из библиографического списка и конспектов установочных лекций.
Библиографический список:
1. Бесков В.С. Общая химическая технология и основы промышленной экологии/ В.С. Бесков, В.С. Сафронов. - М.: Химия, 2005.-472с. 2. Кутепов А.М. Общая химическая технология. Учеб. для техн. вузов/ А.М. Кутепов, Т.И. Бондарева, И.Г. Беренгартен. М.: Высш.шк., 2008.- 448с. 3. Расчеты химико-технологических процессов: Учеб. пособие для ВУЗов./Под ред. И.П. Мухленова. Л.: Химия, 1982.- 248с.
Срок защиты: 25.05.15г.
Руководитель: ст. преподаватель Н.Е. Чернышова
ТАБЛИЦА ВАРИАНТОВ ЗАДАНИЙ НА КОНТРОЛЬНУЮ РАБОТУ ПО КУРСУ «ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ Для студентов ЗФ – III-10; 18; 19
Вопросы по курсу ОХТ 1. Современные проблемы химической технологии, пути их решения 2. Понятие о химико-технологическом процессе (ХТП) как сложной системе. Состав и компоненты ХТП. 3. Понятия технология, способ производства, технологическая операция. 4. Способ переработки, способ производства. Технологическая операция. 5. Предмет химической технологии. Химическая и механическая технология. 6. Типовые технологические процессы. Отраслевое деление химических производств. 7. Технологические критерии эффективности химико-технологического процесса. Понятие «выхода» в химическом процессе. 8. Экстенсивная степень полноты химической реакции. Степень превращения вещества в химической реакции. Селективность химического процесса. 9. Классификация химических реакций, лежащих в основе промышленных химико-технологических процессов. 10. Равновесие химических реакций.Факторы, влияющие на равновесие химической реакции. Методы смещения равновесия. 11. Химическое равновесие. Правила смещения химического равновесия. Принцип Ле-Шателье и его применение для определения условий и способов смещения равновесия, выбора параметров процесса. 12. Понятие и способы выражения константы химического равновесия. 13. Константа равновесия и энергия Гиббса. 14. Факторы влияющие на константу скорости процесса. 15. Расчет изобарно-изотермического потенциала и константы химического равновесия. Уравнение связи изобарно-изотермического потенциала с константой химического равновесия. Расчет теплового эффекта реакции. 16. Уравнение изотермы Вант-Гоффа. Зависимость константы равновесия от температуры. 17. Химическое равновесие в гетерогенных реакциях. 18. Факторы, влияющие на равновесие химической реакции. Способы смещения равновесия. 19. Влияние температуры на степень превращения при протекании обратимой эндотермической реакции. 20. Влияние давления на скорость реакции. 21. Направленность реакций по критерию Гиббса. 22. Последовательность расчета равновесных характеристик для единичной реакции 23. Количественный термодинамический анализ химических реакций. 24. Понятие обратимого и необратимого химического процесса. Закон действия масс. 25. Скорость гомогенных химических реакции. 26. Зависимость скорости химической реакций от концентрации реагентов, кинетические уравнения. 27. Микро- и макрокинетика. Общая форма кинетического уравнения и его параметры. 28. Кинетика и селективность (на примере параллельных реакций) 29. Механизм гетерогенных процессов. Основные стадии. Области протекания гетерогенных процессов. 30. Понятие и примеры гетерогенных химических процессов. Скорость превращений в гетерогенных химических процессах. 31. Фронтальная модель гетерогенного химического процесса. Основные стадии протекания гетерогенного химического процесса по фронтальной модели. 32. Квазигомогенная модель гетерогенного химического процесса. 33. Закономерности поверхностной химической реакции. 34. Закономерности внешней диффузии. Закономерности внутренней диффузии. 35. Константа скорости гетерогенного процесса. Лимитирующая стадия. 36. Кинетические закономерности гетерогенных некаталитических реакций. 37. Кинетические модели гетерогенных некаталитических процессов в системе газ-твердое вещество. 38. Значение катализа в промышленности. Требования к промышленным катализаторам. 39. Понятие катализа и катализатора. 40. Значение и области применения катализа. 41. Примеры промышленных каталитических процессов и катализаторов. 42. Основные характеристики твердых катализаторов. Технологические характеристики твердых катализаторов (активность, селективность, пористая и кристаллическая структура). 43. Сущность катализа, его разновидности. 44. Области применения катализаторов. Катализаторы дегидрирования. 45. Особенности кинетики гетерогенного катализа. 46. Гетерогенно-каталитические процессы. Общие представления о катализе. 47. Технологические характеристики твердых катализаторов (активность, селективность, пористая и кристаллическая структура). 48. Время контакта в гетерогенно-каталитических процессах. Отравление катализаторов. 49. Гомогенный катализ, его механизм. Определение скорости. 50. Влияние условий на эффективность гомогенного каталитического процесса. 51. Гетерогенный катализ и его механизм. Основные стадии гетерогенно-каталитического процесса. Понятие лимитирующей стадии. 52. Модель Ленгмюра-Хиншельвуда для определения скорости гетерогенного каталитического процесса. 53. Кинетические закономерности гетерогенных каталитических реакций. 54. Классификация химических реакторов по характеру изменения параметров процесса во времени и по конструктивным характеристикам. 55. Время химического процесса и способы его выражения. 56. Классификация химических реакторов и режимов их работы. Требования к химическим реакторам. 57. Классификация химических реакторов по гидродинамическому режиму. 58. Реактор идеального смешения, его материальный баланс и характеристическое уравнение. 59. Реактор идеального вытеснения, его характеристическое уравнение. Типы реакторов рассчитываемых по модели идеального вытеснения. 60. Каскад реакторов и метод расчета. 61. Тепловые режимы химических реакторов. Уравнение теплового баланса. 62. Тепловой баланс реактора. Обобщенное уравнение. 63. Адиабатический режим. Уравнение адиабаты. 64. Организация теплообмена в реакционной зоне реакторов. 65. Классификация химических реакторов. Общие положения по проектированию реакторов. 66. Реакторы для гетерогенных и гетерогенно-каталитических процессов. Схемы. 67. Промышленные реакторы для проведения гомогенных процессов 68. Химические реакторы с неидеальной структурой потоков. Модели реакторов с неидеальной структурой потоков. Ячеечная, однопараметрическая диффузионная модель, двухпараметрическая диффузионная модель. 69. Отличия реальных реакторов от их идеальных моделей. Модели реакторов с неидеальной структурой потоков - однопараметрическая диффузионная модель, двухпараметрическая диффузионная модель. 70. Периодический реактор идеального смешения, характеристическое уравнение. 71. Проточный реактор идеального смешения в стационарном режиме. Уравнение материального баланса. 72. Классификация реакторов по тепловому режиму. Тепловые режимы химических реакторов. Уравнение теплового баланса. 73. Конструкции реакторов для проведения гетерогенных каталитических процессов. 74. Промышленные реакторы для проведения гомогенных процессов 75. Сырьевая база химической промышленности. Основные понятия и классификация сырья. 76. Характеристика и классификация сырья химической промышленности. Вторичные материальные ресурсы. 77. Комплексное использование сырья, комбинирование производств. 78. Вода в химической промышленности. Критерии качества воды. 79. Основные процессы промышленной водоподготовки. Замкнутые системы водоснабжения. 80. Энергетическая база химической промышленности. Классификация топливно-энергетических ресурсов. 81. Вторичные энергетические ресурсы и их использование. Технологические характеристики топлива. 82. Воздух в химической промышленности. 83. Классификация промышленных загрязнений биосферы. 84. Общие методы очистки выбросов в химической технологии. 85. Источники загрязнения атмосферы. Очистка отходящих газов химических производств. 86. Сточные воды предприятий химической промышленности. Их состав, свойства, классификация. Водооборотные циклы в химической технологии. 87. Твердые отходы химических производств, основные направления их утилизации. 88. Понятие мало- и безотходных технологии. Основные пути их создания. 89. Классификация моделей ХТС. Технологические принципы создания химико-технологических систем (ХТС) 90. Типовые технологические операторы и связи. Формы представления балансов ХТС.
ЗАДАЧИ Задача 1 Рассчитать конечный состав газовой смеси в массовых процентах. Состав смеси: метан – 16,5 % масс., этан – 9 % масс., кислород – 45% масс., азот – 29,5 % масс. Количество смеси – 1000кг. Каков конечный состав смеси, если удалено: метана -105 кг, кислорода – 300м3 и добавлено водяного пара – 200м3. Задача 2 Рассчитать конечный состав газовой смеси в массовых процентах. Состав смеси: метан – 21% масс., этан – 23 % масс., кислород – 19 % масс., азот – 37 % масс. Количество смеси – 1000 м3. Каков конечный состав смеси, если удалено: метана -50 м3 , кислорода – 100 кг и добавлено водяного пара – 100м3. Задача 3 Рассчитать конечный состав газовой смеси в массовых процентах. Состав смеси: хлористый водород – 50 % масс., водород – 9 % масс., хлор – 4% масс., азот – 37 % масс. Количество смеси – 3000м3. Каков конечный состав смеси, если удалено: хлористого водорода -120 кг, хлор – полностью и добавлено кислорода – 500м3. Задача 4 Рассчитать конечный состав газовой смеси в массовых процентах. Состав смеси: хлористый водород – 70 % масс., водород – 10 % масс., хлор – 2% масс., азот – 18 % масс. Количество смеси – 1500 кг. Каков конечный состав смеси, если удалено: хлористого водорода -300м3 , хлор – полностью и добавлено кислорода – 300кг. Задача 5 Рассчитать конечный состав газовой смеси в массовых процентах. Состав смеси: сернистый ангидрид – 20 % масс., серный ангидрид – 10 % масс., кислород – 50% масс., азот – 20 % масс. Количество смеси – 1 300 м3 . Каков конечный состав смеси, если удалено: серного ангидрида - полностью и добавлено кислорода – 300кг. Задача 6 Рассчитать конечный состав газовой смеси в массовых процентах. Состав смеси: сернистый ангидрид – 30 % масс., серный ангидрид – 20 % масс., кислород – 30% масс., азот – 20 % масс. Количество смеси – 2 500 кг. Каков конечный состав смеси, если удалено: серного ангидрида - полностью, кислорода – 50 кг и добавлено аммиака – 100кг. Задача 7 Рассчитать конечный состав газовой смеси в массовых процентах. Состав смеси: этиловый спирт – 13 % масс., этилен – 50 % масс., этан – 30% масс., метан – 7 % масс. Количество смеси – 3 500 кг. Каков конечный состав смеси, если удалено: этилена - 600 кг, этана – 70 м 3 и добавлено водорода – 100кг. Задача 8 Рассчитать конечный состав газовой смеси в массовых процентах. Состав смеси: этиловый спирт – 6 % масс., этилен – 40 % масс., этан – 30% масс., метан – 24 % масс. Количество смеси – 4500 м 3. Каков конечный состав смеси, если удалено: этилена - 300 кг, этана – 90 м 3 и добавлено водорода – 100 м 3.
Задача 9 Рассчитать конечный состав газовой смеси в массовых процентах. Состав смеси: водород – 26 % масс., кислород – 40 % масс., двуокись углерода – 6 % масс., азот – 28 % масс. Количество смеси – 2500 м 3. Каков конечный состав смеси, если удалено: двуокиси углерода - 200 кг, кислорода – 50 м 3 и добавлено метана – 100 м 3. Задача 10 Рассчитать конечный состав газовой смеси в массовых процентах. Состав смеси: водород – 44 % масс., кислород – 25 % масс., двуокись углерода – 22 % масс., азот – 8 % масс. Количество смеси – 900 кг. Каков конечный состав смеси, если удалено: двуокиси углерода - 50 кг, кислорода – 70 м 3 и добавлено метана – 200 м 3. Задача 11 Определить теоретические расходные коэффициенты железных руд, используемых при выплавке чугуна, содержащего 87 % железа при условии, что в рудах отсутствует пустая порода и примеси. Молекулярная масса железных руд: Шпатовый железняк FeCO3 – 116, красный железняк 2Fe2O2*2H2O – 355, красный железняк Fe3O4 – 232. Задача 12 Рассчитать расход ильменитовой руды и серной кислоты для получения 1 т диоксида титана TiO2, если содержание титана в руде составляет 20 % масс., а степень разложения FeTiO3 – 80 %. В производстве применяют 80 % H2SO4. FeTiO3 + H2SO4 = TiO2 + FeSO4 + H2O Молекулярная масса: FeTiO3 - 152, TiO2 - 80, H2SO4 – 98. Задача 13 Определить расходные коэффициенты в производстве карбида кальция, содержащего: CaC2 –80 % масс., СаО – 15 % масс., С – 3 % масс., прочие примеси – 2 % масс. Известь содержит 90 % СаО. Содержание в коксе: золы - 4 %, летучих - 4%, влаги – 3 %. Расчет вести на 1 т продукта. Молекулярная масса:СаС2 - -64, СаО – 56. СаО + 3 С = СаС2 + СО Задача 14 Определить расход бурого угля (содержащего 70 % масс. углерода), водяного пара и воздуха для получения 1000 м3 генераторного газа состава: СО 40 % об., Н2 –20 % об., N2 – 40 % об. Состав воздуха: N2 - 79 % об., О2 –21 % об., молекулярная масса воздуха – 29. С + Н2О = СО + Н2 2 С + О2 = 2 СО Задача 15 Рассчитать расходные коэффициенты для соляно-сульфатного производства (на 1 т Na2SO4), если в производстве используется поваренная соль, содержащая 90 % NaCl, и купоросное масло, содержащее 90% H2SO4. Степень разложения NaCl составляет 80%. Определить количество получающегося при этом хлороводорода.
Задача 16 Определить расход технического карбида кальция, содержащего 80% СаС2, для получения 1000 м3 ацетилена, если степень разложения СаС2 составляет 0,9. Задача 17 При обжиге 1 т известняка образуется 150 м3 диоксида углерода. Содержание СаСО3 в известняке 90 %. Определить степень разложения известняка и расход известняка на 1000 м3 СО2 при тех же условиях и при полном разложении СаСО3 Задача 18 Определить расходный коэффициент технического карбида кальция в производстве ацетилена (на 1000кг ацетилена). Содержание СаС2 в техническом продукте 80 %, а степень использования СаС2 в производстве 0,8 Задача 19 Определить количество аммиака, требуемое для производства 10 000 т/год азотной кислоты и расход воздуха на окисление аммиака, если выход оксида азота 0,9 содержание аммиака в сухой аммиачно-воздушной смеси 10% масс. Молекулярная масса:аммиака –17, азотной кислоты - -63. NH3 + 2O2 = HNO3 + H2O Задача 20 При термоокислительном крекинге метана (с целью получения ацетилена) смесь газов имеет состав (% об.): С2Н2 –9, Н2 –50, СО –25, СО2 –5, С2Н4 –1, СН4 – 5, Ar –5. Определить количество метана, которое нужно подвергнуть крекингу, чтобы из отходов крекинга после отделения ацетилена получить 1 т метанола: СО + 2 Н2 = СН3 ОН. По практическим данным из 1 т исходного метана получается после отделения ацетилена 1160 кг смеси газов. Задача 21 Рассчитать расход реагентов на 1т фосфора при восстановлении его из фосфоритного концентрата, если процесс может быть описан следующим уравнением: Са3(РО4)2 + 5С + 3SiO2 = 3 CaO*SiO2 +2P +5 CO Содержание Са3(РО4)2 в концентрате 25%. Кокс содержит 90% углерода. 95% углерода. Задача 22 При газификации кокса (содержащего 97% С и 3% Н2О по массе) с водяным паром полученный водяной газ содержит 10 % СО2 (по объему). Рассчитать состав полученного газа и составить материальный баланс процесса газификации на 1 т кокса указанного состава. При газификации протекают реакции: С + Н2О = СО + Н2 (основная) СО + Н2О = СО2 + Н2 (побочная) Задача 23 Составить материальный баланс контактного аппарата для каталитического окисления SO2 в SO3 производительностью 10 000 м3/ час исходного газа следующего состава(% об): SO2 –9, О2 –12, N2 –79. Степень окисления SO2 в SO3 составляет 90%. SO2 + 0,5 О2 = SO3
Задача 24 Составить материальный баланс нитратора производительностью 3 т/час. Нитробензола. Выход нитробензола 90 % от теоретического. Состав нитрующей смеси (%массю):HNO3- 80, H2O –20. Расход нитрующей смеси составляет 4 кг на 1 кг бензола: С6Н6 + НNO3 =C6H5NO3 + H2O Задача 25 Рассчитать материальный баланс нейтрализатора для получения аммиачной селитры производительностью 20 т NH4NO3 в час. В производстве применяется 50% азотная кислота и 100% газообразный аммиак. Потери азотной кислоты и аммиака 1 % от теоретически необходимого количества для обеспечения заданной производительности. HNO3 + NH3 = NH4NO3 Задача 26 Рассчитать материальный баланс печи окислительного обжига в производстве ванадата натрия NaVO3. Сырье: ванадиевый шлак, содержащий 15%масс. V2O5, воздух, NaCl (расход NaCl составляет 10% масс от массы шлака). Расчет вести на 1 т готового продукта. Молекулярная масса: NaVO3 -122, V2O5 -182, NaCl –59. 1 стадия 2 NaCl + 0,5 О2 =Na2O + Cl2 2 стадия Na2O + V2O5 = 2 NaVO3 Задача 27 Составить материальный баланс окисления аммиака (на 1 т азотной кислоты). Степень окисления аммиака до оксида азота – 0,9, до азота – 0,1, оксида азота до диоксида азота - 1. Содержание аммиака в сухой аммиачновоздушной смеси 15 % масс. NH3 + 2O2 =HNO3 + H2O 4NH3 + 5O2 = 4 NO + 6 H2O 4NH3 + 3O2 = 4N2 + 6 H2O Задача 28 Составить материальный баланс сжигания колчедана в печи. Производительность печи по колчедану 200т/сут. Содержание, %: серы в колчедане – 41, диоксида серы в сухом печном газе –14. 4 FeS2 +11 O2 = 2Fe2O3 + 8 SO2 Задача 29 Составить материальный баланс реактора для каталитического окисления метанола в формальдегид. Производительность реактора 1 000 т метанола в год. Степень превращения метанола в формальдегид 0,6. СН3ОН + 0,5 О2 = СН2О + Н2О Задача 30 Составить материальный баланс реактора для каталитического дегидрирования изопропилбензола в альфа-метилстирол. Производительность реактора 20 000 т альфа-метилстирола в год. Степень превращения изопропилбензола в альфа-метилстирол 0,8. С6Н5СН(СН3)2 = С6Н5ССН2СН3 + Н2
Задача 31. Подсчитать количество теплоты (кДж), выделяющееся при образовании 400 л ацетилена из карбида кальция. Теплоты образования, кДж/кмоль: СаС2– 62 700; Н20 –241 840: СаО–635 100; С2Н2– 226 750. Задача 32. Определить количество теплоты, образующееся при сгорании 1 м3 и 1 кг этана. Теплота сгорания этана в стандартных условиях 1 559 880 кДж/кмоль. Молекулярная масса этана –30. Задача 33. Определить теоретическую теплотворную способность чистого колчедана, содержащего 45% Sи 5% С. 1 кг чистого колчедана при сгорании дает 7060 кДж, а 1 кг чистого углерода–32700 кДж. Молекулярная масса: FeS2–120. Задача 34. Вывести общую формулу для определения теплотворной способности колчедана в зависимости от содержания в нем серы п. Теплоты образования (кДж/моль) реагентов и продуктов реакции: Fe203– 821,3; SO2– 296,90; FeS2–177,4. Чистый колчедан содержит 53,35% S. Задача 35. Определить температуру горения цинковой обманки, содержащей 96% ZnS. Состав обжиговых газов [% (об.)]: SO2– 7; 02– 11 и N2– 82. Потери теплоты печью в окружающую среду (без дополнительного охлаждения) 13% от выделяющейся. В ходе обжига выгорает 98% ZnS. Теплоемкость, кДж/(м3-сС): N2–1,382; 02–1,482; SO2–2,215. Молекулярная масса ZnS– 97,4. Задача 3 6. Вывести общую формулу для определения теплотворной способности цинковой обманки, содержащей п% серы. Теплоты образования при 25 °С (кДж/моль): ZnO– 349; ZnS–201; O2– 297. Молекулярная масса: ZnS– 97,4; S– 32. ZnS+ 1,5O2 = ZnO+ SO2+ Q: Задача 3 7. Рассчитать теоретическую температуру горения этана при избытке воздуха 20% (α = 1,2). Теплота сгорания этана 1 560 997 кДж/кмоль. реакция горения этана протекает по уравнению: С2Н6 + 3,5O2 + 0,7O2 + 4,2 · 79/21N2= 2СО2 + ЗН2O(пар) + 0,7O2 + 4,2 ·3,76N2 Задача 3 8. Рассчитать теоретическую температуру горения метана природного газа при избытке воздуха 35%. Теплота сгорания метана 890 310 кДж/моль. Реакция горения метана: СН4 + 2O2 + 0,5O2 + 2,5 ·3,76N2= СО2 + 2Н2O(пар) + 0,5O2 + 2,5 ·3,76N2 Задача 39. Степень окисления SO2 в SO3 составляет: х1= 0,5 и x2 = 0,9. Рассчитать изменение температуры в зоне реакции, если средняя теплоемкость газовой смеси, содержащей [% (об.)] SO2– 8, O2– 11 и N2 –81, условно принимается неизменной и равной 1,382 кДж/(м3·°С).
Задача 40. Рассчитать повышение температуры при окислении SO2 на 10% при 500°С для газовой смеси состава [(% (об.)]: SO2–7; O2– 12 и N2– 81. Теплоемкость, кДж/(м3·°С): SO2– 2,082; O2–1,402; N2–1,343. Расчет вести на 1 м3 газа.
Задача 41. Определить, какую температуру теоретически можно получить в реакционной зоне шахтной печи для обжига известняка при избытке воздуха α = 2 и α = 3 от требуемого по стехиометрическому количеству, считая, что в исходной шихте находится чистый углерод. При расчете не учитывать тепловые эффекты идущих в печи реакций и теплопотери. Теплотворная способность углерода 32 784 кДж/кг. Теплоемкость воздуха в пределах 0–900°С 1,038 кДж/(кг·°С), Задача 4 2. При обжиге шихты, содержащей 19 т известняка и кокс, определить: 1) расход кокса состава [% (масс.)]: С – 91; золы – 7; влаги – 2; 2) состав обжиговых газов в процентах (по объему); 3) тепловой эффект реакции обжига. Степень диссоциации при обжиге известняка 95%. Воздух подается с избытком α = 1,4. Теплоты образования, кДж/кмоль: СаСО3– 1 206 000; СаО – 635 100; СО2– 393 510. Теплотворная способность чистого углерода 32 784 кДж/кг. Термическое разложение известняка идет согласно реакции: СаСO3↔СаО + СO2–Q. Задача 4 3. Определить количество теплоты, выделяющееся при обжиге 11 т FeS2, содержащего 38% серы, если степень выгорания серы из колчедана 0,96. Чистый FeS2 содержит 53,35% серы и 46,65% железа. Молекулярная масса: 4FeS2 – 480. Задача 4 4. На 1-й слой контактного аппарата при 450°С подается 5000 м3/ч исходной газовой смеси, содержащей [% (об.)]: SO2–10; 02–11 и N2 – 79. В результате экзотермической реакции SO2+½O2↔О3 + Q’ (где Q' – 101 420 – 9,26 Тср) температура газа повысилась до 580 °С. Определить степень окисления SO2 в SO3, если принять теплоемкость газа неизменной и равной 1,38 кДж/(м3·°С) (изменением объема в результате реакции пренебрегаем). Задача 4 5. Определить теоретический расход мазута для получения 17 т оксида алюминия из гидроксида алюминия. Теплота сгорания мазута 41 870 кДж/кг. Теплоты образования (кДж/моль): Аl(ОН)3– 1243; А12O3– 1676,0; Н2O–241,84. Молекулярная масса: А12O3– 102. Задача 4 6. Рассчитать расход природного газа, содержащего [% (об.)]: СН4– 82; гомологов – 9, для производства 200 т/сутки глинозема (А12O3). Потери теплоты в окружающую среду составляют 5% от общего расхода. Температура в зоне реакции 1200°С. Температура реагентов, поступающих в печь, 20 °С Теплотворная способность газа 33 950 кДж/м3. Теплота образования (кДж/моль): А1(ОН)3–1243; А12O3– 1676,0; Н2O–241,84, Теплоемкость [кДж/(кг·°С)]: Аl(ОН)з при 20 °С– 0,879; А12O3 и Н2O при 1200 °С – 1,327 и 2,12 соответственно. Молекулярная масса: 2А1(ОН)3–156; А12O3– 102; ЗН2O– 54. Задача 4 7. Рассчитать тепловой эффект реакции получения хлороводорода 2NaCl+ H2SO4= Na2SO4+ 2НС1 –q и расход топлива (без учета теплоты сырья) на 5 т хлороводорода, если в качестве топлива используют коксовый газ примерного состава [% (об.)]: Н2– 56; СН4– 25; С2Н4– 2,5; СО – 7,0; СO2– 2,6; O2– 0,7, N2– 5,7. Теплоты образования (кДж/кмоль): NaCl– 410 900; H2SO4– 811 300; Na2SO4–1 384 000; НС1 – 92 300. Теплотворная способность (кДж/кмоль): Н2– 285 840; СН4– 890 310; С2Н4– 1 410 970; СО – 83 010. Молекулярная масса НС1– 36,5. Задача 4 8. Какое количество теплоты выделится при хлорировании 20 т бензола, если конечная смесь содержит 39% хлорбензола, 1% дихлорбензола, 60% бензола. Теплоты образования (кДж/моль): С6Нб– 49,063; С6Н5С1 – 52,17; C6H4Cl2– 53,05; НСl– 92,36. Молекулярная масса: С6Н6– 78; С6Н5С1 – 112,5; С6Н4С12– 146. Задача 4 9. Подсчитать: а) объем сухого воздуха для полного сгорания газа полукоксования бурого угля, если коэффициент избытка воздуха α =1,2; б) состав продуктов сгорания; в) теплотворную способность (кДж/м3) газа полукоксования. Состав газа [% (об.)]: СН4– 60; Н2– 20; другие углеводороды (считая на С2Н4) –3; СО –6; СO2–6,8; O2–0,04; N2–4,16. Теплоты сгорания компонентов газа (кДж/кмоль): СН4–890 310; С2Н4– 1 410 970; Н2– 285 840; СО – 283 010. Расчет вести на 5000 м3 или на 5000 кмоль газа. Задача 5 0. Определить количество теплоты, выделяющейся при газификации твердого топлива, если из генератора водяного газа выходит газ состава [% (об.)] - СО – 38; Н2– 50; CO2– 6,2 и N2– 5,8. Расчет вести на 1000 м3 генераторного газа. Теплоты образонания (кДж/моль): СО – 110,58; CO2– 393,79; Н20 (пар)–242,0. Задача 5 1. В сатуратор, содержащий 200 кг 76% раствора серной кислоты, подается 34 кг газообразного аммиака, барботирующего через раствор. Определить, какое количество теплоты может быть использовано для испарения реакционной воды, если первоначальная температура кислоты и аммиака 25 °С, а потери теплоты сатуратором в окружающую среду равны 9% от общего прихода теплоты.
Задача 5 2. Подсчитать температуру горения мазута состава [% (масс.)]: С –87; Н2–10,8; 02– 1,0; S–0,7; N2–0,5. Воздух для горения, содержащий в 1 м3 0,015 м3 Н20, подается с избытком α = 1,36. Мазут и воздух поступают в топку с температурой 20°С. Общие теплопотери (стенками топки и факелом) равны 6,5% от общего прихода теплоты. Расчет вести на 100 кг мазута. Задача 5 3. Рассчитать температуру горения эстонского сланца состава [% (масс.)]: С –70; Н2–6,5; 02–10; S–2,0; N2–1; зола – 5,5; влага – 5. Коэффициент избытка воздуха α =1,55. Относительная влажность воздуха 100%. Сланец и воздух поступают в топку с температурой 25 °С. Теплопотери (теплоотдача через стенки котла и унос теплоты со шлаком) 10% от общего прихода теплоты. При 25 °С влажность при насыщении 23,1 г/м3. Расчет вести на 50 кг сланца. Горение протекает до конечных продуктов окисления по реакциям: С + 02→CO2 (1); H2 + ½02→H20 (2);S+ 02→SO2 (3) Задача 54. Рассчитать объем полимеризатора vn и составить тепловой баланс первого полимеризатора (в кДж на 11 т исходного стирола) при коэффициенте заполнения реактора φ3 = 0,65 и рабочем объеме аппарата vp= 1,8 м3. Плотность стирола d20= 0,906. Теплоемкость, кДж/(кг·°С): стирола – при 50 °С 1,742, при 145 °С 2,479; полистирола – при 20 °С 1,457, при 145 °С 3,119. При производстве пластической массы – блочного полистирола – в каскаде аппаратов с мешалками процесс проводят при изотермическомрежиме, для чего используют дисковые мешалки с развитой поверхностью. Некоторые параметры процесса:
Реакция полимеризации мономера – стирола–с образованием полистирола:
(тепловой эффект взят на основе опытных данных из расчета на мономер, молекулярная масса которого 104). Задача 5 5. Подсчитать тепловой баланс контактного аппарата для частичного окисления SO2производительностью 45000 м3/ч. Газовая смесь содержит [% (об.)]: SO2– 9; 02– 11; N2– 80. Степень окисления 88%. Температура входящего газа 460°С; выходящего– 580 °С. Средняя теплоемкость смеси (условно считаем ее неизменной) 2,052 кДж/(м3·°С). Потери теплоты в окружающую среду 5% от прихода теплоты. SO2+½02↔ SO3 + 94 207 кДж. Состав (м3) газа: Исходный После аппарата SO2 2 250 SO3 2250 · 0,88 = 1980 N2 20 000 SO2 2250–1980 = 270 02 2 750 N2 20 000 02 2750–1980/2= 1760 Итого: 25 000 Итого: 24 010 Задача 5 6. Составить тепловой баланс (на 1 ч работы) стадии пиролиза при производстве уксусного ангидрида из ацетона и рассчитать количество природного газа, содержащего [% (об.)]: СН4– 98; N2– 2. Производительность по уксусному ангидриду 30 т/сутки. Температура пиролиза 800 °С. Степень превращения ацетона в кетен за один цикл 0,35. Теплота испарения ацетона 553,5 кДж/кг. Теплоемкость [кДж/(кг·°С)]| ацетона при 20 °С 2,09, реакционной смеси при 800 °С 2,26. Теплотворная способность чистого метана 890 310 кДж/кмоль. Стадии производства уксусного ангидрида из ацетона описываются реакциями:
Задача 57. Составить тепловой баланс реактора для получения водорода каталитической конверсией метана. Потери теплоты в окружающую среду 8% от прихода теплоты. Отношение СН4:Н20=1:2. Температура поступающих в реактор реагентов 105 °С; температура в зоне реакции 900 °С. Теплоемкость [кДж/ (кмоль • °С) ]:
Расчет вести на 2000 м3 Н2. Расчет ведется по реакции: СН4 + Н20 ↔ СО = ЗН2– 206 200 кДж Задача 5 8. Составить тепловой баланс генератора водяного газа при газификации 1 т кокса, содержащего [% (масс.)]: С – 93, золы –4 и Н20 – 3, – и подаче 1575 кг водяного пара на 1 т кокса. Образовавшиеся 2190 кг водяного газа содержат [% (масс.)]: СО –89,9, CO2–1,94 и Н2– 8,16. Температура водяного газа на выходе из генератора 1000°С, температура подаваемого кокса 25 °С и водяного пара 100 °С. Теплота образова- Теплоемкость, Молекулярная ния, Дж/(моль·0С) (при масса кДж/кмоль (при указанной темпера- 25 °С) туре) С 12 – 8,53 Н20 18 241 840 33,2 СО 28 110 500 31,7 Н2 2 – 29,8 CO2 44 393 510 49,3 Процесс газификации протекает по реакциям:
Задача 5 9. Составить тепловой баланс печи КС-200 по данным таблицы материального баланса.
Температура в кипящем слое 800 °С. Потери теплоты 4% от прихода. Теплоемкость [кДж/(м3·К)] при 20°С: колчедана–0,538 кДж/(кг·К); воздуха-1,3097 [1,0119 кДж/(кг·К)]; Н20 – 2,006; при 800°С: огарка – 0,883 кДж/(кг·К); S02–4,187 (0,437 + 0,0000847 Т) = 2,428; O2–1,571; N2–1,463; Н20 – 1,884. Задача 60. Определить теоретический расход мазута для получения 47 т оксида алюминия из гидроксида алюминия. Теплота сгорания мазута 41 870 кДж/кг. Теплоты образования (кДж/моль): Аl(ОН)3– 1243; А12O3– 1676,0; Н2O–241,84. Молекулярная масса: А12O3– 102. Задача 61 Определить объем РИВ, необходимый для достижения степени превращения вещества А в реакции первого порядка
Х=75%, если · Концентрация вещества А на входе в реактор Са,0=2 моль/мл; · Объемная скорость подачи сырья V0=1,5 м3/мин; · Константа скорости реакции k= 0,3 мин-1. Рассчитать состав продуктов реакции. Задача 62 Определить степень превращения вещества А в реакции первого порядка
Протекающей в непрерывном РИС, если · Концентрация вещества А на входе в реактор Са,0=1 кмоль/м3; · Условное время контакта τ=10 мин; · Константа скорости реакции k= 0,253 мин-1. Рассчитать состав продуктов реакции. Задача 63 Определить время необходимое для достижения 40 % конверсии вещества А в реакции первого порядка
Протекающей в периодическом РИС, если за 5 мин в тех же условиях превращается 80% этого вещества. Начальная концентрация вещества А составляет Са,0=1 моль/мл; Рассчитать состав продуктов реакции при конверсии 40% и 80%. Задача 64 Определить степень превращения вещества А в реакции первого порядка
Протекающей в РИВ, если · Объем реактора Vр=2 м3; · Концентрация вещества А на входе в реактор Са,0= 2 кмоль/м3; · Объемная скорость подачи сырья V0= 2 м3/мин; · Константа скорости реакции k= 2
|