Комплексы
Перламутровые облака образуются в стратосфере, на огромных высотах около 20-30 км, и состоят, по-видимому, из кристалликов льда или переохлажденных капель воды. Это очень слабо изученный вид атмосферных объектов. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Методические указания к лабораторным работам по курсу «ХИМИЯ»
СОСТАВИТЕЛИ: БЕЛОВА С.Б ГРИШИНА Н.Д. БЕЛОВ С.П.
МОСКВА 2011
Комплексные соединения. Методические указания к лабораторным работам по курсу «Химия»/ сост. С.Б.Белова, Н.Д.Гришина, С. П. Белов ─ М.: МАТИ, 2011 ─ 20 с.
© Белова С.Б., Гришина Н.Д., Белов С.П., составление, 2011 © МАТИ, 2011 ВВЕДЕНИЕ Комплексные соединения широко распространены в природе. Они играют большую роль в жизнедеятельности организмов; например, гемоглобин, хлорофилл являются комплексными соединениями. Комплексные соединения применяются в химическом анализе, в технологии при получении ряда металлов (золота, серебра, металлов платиновой группы и др.), для разделения смесей элементов, например, лантаноидов. Огромная область применения комплексов переходных металлов — каталитические процессы. Целью данной работы является изучение строения комплексных соединений и их химических свойств.
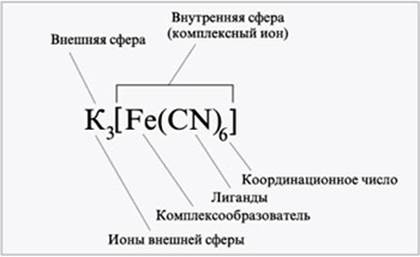
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Комплексы Комплексные (или координационные) соединения – сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму. Эти соединения имеют в своем составе устойчивые группы, называемые комплексами, которые переходят без изменений из одного соединения в другое и сохраняются при растворении соединений. Согласно координационной теории швейцарского ученого А. Вернера комплексные соединения состоят из 2-х сфер: – внешней и – внутренней. Внутренняя сфера, называемая также комплексом, включает: – центральный ион (Cd2+, Fe3+) или атом – комплексообразователь – вокруг центрального иона или атома координируются отрицательно заряженные ионы (CN) или нейтральные молекулы (NH3). Ионы или молекулы, координируемые комплексообразовате-лем, называют лигандами. При записи комплексного соединения внутреннюю сферу или комплекс заключают в квадратные скобки. Координационное число – число лигандов, координируемых комплексообразователем (4 и 6 соответственно). В зависимости от заряда различают комплексы: - анионные ([PbF6] 2-) - катионные ([Cd(NH3)4] 2+) - нейтральные ([Ni(CO)4]). Нейтральные комплексы не имеют внешней сферы. Заряд комплекса равен алгебраической сумме заряда центрального иона и зарядов лигандов.
|