Примеры решения задач. Пример 7.1. Напишите математическое выражение закона действия масс для реакций: а) 2NO(г) + CI2 (г) = 2NOCI (г);
Пример 7.1. Напишите математическое выражение закона действия масс для реакций: а) 2NO(г) + CI2 (г) = 2NOCI (г); б) СаО(к) + СО2 (г) = СаСО3 (к) Решение. а) v = kСNO2 СCI2; б) Поскольку СаО – твердое вещество, концентрация которого не изменяется в ходе реакции, закон действия будет иметь вид: v = kССО2. Пример 7.2. Как изменится скорость реакции 2NO(г) + О2 (г) ® 2NO2 (г), если уменьшить объем реакционного сосуда в 3 раза? Решение. До изменения объема, скорость реакции выражалась уравнением: v = kСNO2 СO2 ; вследствие уменьшения объема концентрация каждого из реагирующих веществ возрастает в три раза. Следовательно, теперь, v' = k(3СNO)2 3СO2 = 27kСNO2 СO2. Сравнивая выражения для скоростей v и v', находим, что скорость реакции возрастает в 27 раз. Пример 7.3. Реакция между веществами А и В выражается уравнением 2А + В = D. Начальные концентрации составляют: СА = 5 моль/л, СВ = 3,5 моль/л. Константа скорости равна 0,4. Вычислите скорость реакции в начальный момент и в тот момент, когда в реакционной смеси останется 60% вещества А. Решение. По закону действия масс v = Пример 7.4. При 323 К некоторая реакция заканчивается за 30 с. Определите, как изменится скорость реакции и время ее протекания при 283 К, если температурный коэффициент скорости реакции равен 2. Решение. По правилу Вант-Гоффа находим, во сколько раз изменится скорость реакции:
Скорость реакции уменьшается в 16 раз. Скорость реакции и время ее протекания связаны обратно пропорциональной зависимостью. Следовательно, время протекания данной реакции увеличится в 16 раз и составит 30 × 16 = 480с = 8 мин. Задачи 121. Как изменится скорость реакции в системе СО(г) + 3Н2(г) = СН4(г) + H2O(г), если концентрации исходных веществ уменьшить в 2 раза? (Ответ: уменьшится в 16 раз). 122. Реакция разложения вещества АВ выражается уравнением 2АВ = А2 + В2. Константа скорости данной реакции равна 2·10–4. Начальная концентрация САВ = 0,32 моль/л. Определите скорость в начальный момент и в тот момент, когда разложится 50% АВ. (Ответ: 2,04. 10-4 ; 5,1 . 10-5). 123. Реакция между веществами А и В выражается уравнением А+2В=D. Начальные концентрации: СА = 0,3 моль/л и СВ = 0,4 моль/л. Константа скорости равна 0,8. Вычислите, какова стала скорость реакции в тот момент, когда концентрация вещества А уменьшилась на 0,1 моль. (Ответ: 6,4 . 10-3). 124. Чему равен температурный коэффициент скорости реакции, если при понижении температуры на 30°, время протекания реакции увеличилось в 64 раза? (Ответ: 4). 125. Во сколько раз увеличится скорость реакции при повышении температуры реакции от 200 до 600 С, если температурный коэффициент скорости реакции равен 2? (Ответ: 16). 126. Как изменится скорость реакции CO + Cl2 = COCl2, если повысить давление в 3 раза? (Ответ: увеличится в 9 раз). 127. Скорость реакции А + 2В = АВ2 при СА= 0,5моль/л и СВ= 0,06моль/л равна 0,18. Определите константу скорости реакции. (Ответ: 100). 128. Реакция идет по уравнению H2 +I2=2HI. Константа скорости равна 0,16. Исходные концентрации водорода и иода соответственно равны 0,04моль/л и 0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда концентрация Н2 станет равной 0,03 моль/л. (Ответ: 3,2 . 10-3; 1,9 . 10-3). 129. Окисление серы и ее диоксида протекает по уравнениям: а) S(к) + О2(г) = SO2(г); б) 2SO2(г) + О2(г) = 2SO3(г) Как изменится скорость каждой из этих реакций, если объем каждой из систем уменьшить в 4 раза? (Ответ: увеличится в 16 раз, 64 раза). 130. Константа скорости реакции 2А + В = D равна 0,8. Начальные концентрации: СА= 2,5 моль/л и СВ = 1,5 моль/л. В результате реакции концентрация вещества СВ оказалась равной 0,6 моль/л. Вычислите, чему стала равна СА и скорость реакции. (Ответ: 0,7; 0,235). 131. При 700С некоторая реакция заканчивается за 56 с. Сколько времени будет длиться эта реакция при 1000С, если температурный коэффициент реакции равен 2? (Ответ: 7с). 132. Во сколько раз увеличится скорость реакции при повышении температуры на 40 градусов, если температурный коэффициент равен 3? (Ответ: 81). 133. Как изменится скорость реакции 2А + В = С, если объем газовой смеси увеличить 3 раза? (Ответ: уменьшится в 27 раз). 134. При 100С реакция заканчивается за 20 минут. Сколько времени будет длиться реакция при повышении температуры до 400С, если температурный коэффициент равен 3? (Ответ: 44,4 с). 135. Как изменится скорость реакции 2NO + O2 = 2NO2, если давление в сосуде увеличить в 2 раза? (Ответ: увеличится в 8 раз). 136. Скорость реакции А + 2В = АВ2 при СА= 0,15моль/л и СВ= 0,4моль/л равна 0,28. Определите константу скорости. (Ответ: 11,67). 137. Как изменится скорость реакции 2А + В = А2В, если концентрацию вещества А увеличить в 3 раза, а концентрацию вещества В уменьшить в 2 раза? (Ответ: увеличится в 4,5 раза). 138. Как изменится скорость реакции N2 + 3H2 = 2NH3, если объём газовой смеси увеличится в 2 раза? (Ответ: уменьшится в 16 раз). 139. В системе 2NO + O2 = 2NO2 концентрацию NO увеличили в 3 раза, а концентрацию O2 в 2 раза. Во сколько раз возросла скорость реакции? (Ответ: 18). 140. При 100°С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент скорости равный 2, рассчитать через какое время закончится эта реакция при 60°С. (Ответ: 256 мин).
|

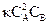 . В начальный момент скорость v1 = 0,4 × 52 × 3,5 = 35. По истечении некоторого времени в реакционной смеси останется 60% вещества А, т. е. концентрация вещества А станет равной 5 × 0,6 = 3 моль/л. Значит, концентрация А уменьшилась на 5 – 3 = 2 моль/л. Так как А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества В уменьшилась на 1 моль и стала равной 3,5 – 1 = 2,5 моль/л. Следовательно, v2 = 0,4 × 32 × 2,5 = 9.
. В начальный момент скорость v1 = 0,4 × 52 × 3,5 = 35. По истечении некоторого времени в реакционной смеси останется 60% вещества А, т. е. концентрация вещества А станет равной 5 × 0,6 = 3 моль/л. Значит, концентрация А уменьшилась на 5 – 3 = 2 моль/л. Так как А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества В уменьшилась на 1 моль и стала равной 3,5 – 1 = 2,5 моль/л. Следовательно, v2 = 0,4 × 32 × 2,5 = 9.
 =
=  = 2–4 =
= 2–4 =  .
.


