Теоретическая часть. Теплоемкостью тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один градус:
Теплоемкостью тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один градус:
Удельной теплоемкостью вещества называется теплоемкость единицы массы вещества:
Молярной теплоемкостью вещества называется теплоемкость массы вещества, равной молярной массе этого вещества:
где m /m - количество молей вещества. Величина теплоемкости зависит от условий нагревания. Процесс нагревания вещества при постоянном объеме характеризуется "теплоемкостью при постоянном объеме" с v, а при постоянном давлении – "теплоемкостью при постоянном давлении" ср . Для этих теплоемкостей всегда справедливо соотношение сp > c v – это доказывается с помощью термодинамических законов. Например, для идеального одноатомного газа молярные теплоемкости c v = Для твердых тел различие между этими теплоемкостями пренебрежимо мало, так как объем твердых тел при нагревании меняется мало ( Из теории теплоемкости твердых тел, разработанной Эйнштейном и Дебаем, вытекают следующие важные положения, касающиеся поведения теплоемкости при низких и высоких температурах: а) при стремлении абсолютной температуры к нулю теплоемкость тела также стремится к нулю
б) при температурах, существенно превышающих значение так называемой характеристической температуры Дебая Т Д, молярная теплоемкость химически простых тел в кристаллическом состоянии есть величина постоянная, и равная
где R = 8,31 Дж/(моль×К) – универсальная газовая постоянная. Последнее утверждение составляет содержание закона Дюлонга и Пти, установленного опытным путем и подтверждаемого классической статистической физикой. Действительно, из закона равномерного распределения энергии по степеням свободы следует, что на каждую степень свободы приходится энергии kT /2 (
здесь NА = 6,02×1023 моль-1 – постоянная Авогадро. Теплоемкость кристаллов оказывается не зависящей от температуры и от конкретных свойств кристаллов. Характеристические температуры Дебая некоторых кристаллов приведены в таблице 1. Таблица 1
Из приведенной таблицы характеристических температур следует, что для кристаллов от свинца (Pb) и до поваренной соли (NaCl) комнатная температура (~ 300К) и более высокие температуры являются сравнительно большими. Поэтому для подобных кристаллов отклонения от закона Дюлонга и Пти в этой области температур не велики. Но, например, для бериллия и алмаза поведение теплоемкости при умеренных температурах совершенно отличается от закона Дюлонга и Пти. На рис.1 показана температурная зависимость теплоемкости кристалла меди.
Рис.1 Температурная зависимость теплоемкости меди
|

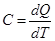 .
.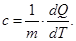
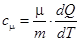 , (1)
, (1)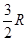 , а ср =
, а ср =  .
.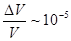 при изменении температуры на 1 К). Поэтому говорят просто о теплоемкости твердого тела.
при изменении температуры на 1 К). Поэтому говорят просто о теплоемкости твердого тела.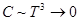 ,
, с m = 3 R,
с m = 3 R,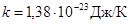 - постоянная Больцмана). В кристаллическом состоянии атомы совершают малые колебания вблизи положения равновесия. На каждую колебательную степень свободы приходится энергия kT, равная сумме средних значений кинетической и потенциальной энергий. Число колебательных степеней свободы из кристалла, содержащего N атомов, равно 3 N. Поэтому средняя энергия теплового движения в кристалле равна
- постоянная Больцмана). В кристаллическом состоянии атомы совершают малые колебания вблизи положения равновесия. На каждую колебательную степень свободы приходится энергия kT, равная сумме средних значений кинетической и потенциальной энергий. Число колебательных степеней свободы из кристалла, содержащего N атомов, равно 3 N. Поэтому средняя энергия теплового движения в кристалле равна 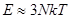 . Соответствующая молярная теплоемкость равна
. Соответствующая молярная теплоемкость равна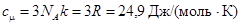 ,
,



