Задачи и упражнения для самостоятельного решения. 25.1. Закончить уравнения реакций: а) KMnO4 + H2S + H2SO4 = ;
25.1. Закончить уравнения реакций: а) KMnO4 + H2S + H2SO4 = …; б) H2S + H2O2 = …; в) H2S + NaOH = …; г) Na2S + H2O ↔ …. 25.2. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? Составить уравнения реакций взаимодействия H2SO3: а) с сероводородом; б) с кислородом. 25.3. Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Написать уравнения реакций взаимодействия разбавленной серной кислоты с магнием и алюминием и концентрированной – с медью и серебром. 25.4. Какой объем диоксида серы SO2 при нормальных условиях можно получить при сжигании серы массой 500 г? (Ответ: 350 л). 25.5. Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при взаимодействии: а) с магнием; б) с иодом; в) с сероводородом? Составить уравнения соответствующих реакций. 25.6. Можно ли окислить сероводород кислородом при 298 К? Ответ мотивировать, вычислив Δ G ° реакции 2H2S (г) + O2 (г) = 2S (к) + 2H2O (ж). ( (Ответ: –407 кДж). 25.7. Раствор, содержащий 5,12 г серы в 100 г сероуглерода CS2, кипит при 46,67 °С. Температура кипения чистого сероуглерода 46,20 °С. Эбулиоскопическая константа сероуглерода 2,37. Вычислить молекулярную массу серы и установить, из скольких атомов состоит молекула серы. (Ответ: 258; S8). 25.8. Через 100 мл 0,2 М раствора NaOH пропустили 448 мл SO2 (н.у.). Какая соль образовалась? Найти ее массу. (Ответ: NaHSO3; 2,08 г). 25.9. Закончить уравнения реакций: а) H2S + SO2 = …; б) H2SO3 + I2 = …; в) KMnO4 + SO2 + H2O = …; г) HIO3 + H2SO3 = …. 25.10. Привести примеры уравнений реакций (не менее двух на каждый случай) получения SO2, которые: а) сопровождаются изменением степени окисления серы; б) не сопровождаются изменением степени окисления серы. 25.11. Закончить уравнения реакций: а) S + KOH = …; б) HNO2 + H2S = …; в) Na2S + NaNO3 + H2SO4 = …; г) H2S + KMnO4 + H2O = …. 25.12. Написать уравнение реакции получения сернистого газа (SO2) из железного колчедана (FeS2). Рассчитать объем SO2 (условия нормальные), который получится при окислении 1,5 кг железного колчедана. (Ответ: 560 л). 25.13. Закончить уравнения реакций гидролиза в молекулярном и ионном виде: а) Na2S + H2O ↔ …; б) (NH4)2S + H2O = …; в) Al2S3 + H2O = …; г) Cr2(SO4)3 + Na2S + H2O = …. 25.14. Закончить уравнения реакций взаимодействия серной кислоты с металлами: а) Cu + H2SO4 (конц.) = …; б) Mg + H2SO4 (конц.) = …; в) Hg + H2SO4 (конц.) = …; г) Ni + H2SO4 (разб.) = …. 25.15. В 10 л воды растворили 2,24 л газообразного SO3 при нормальных условиях. Рассчитать молярную и молярную концентрацию эквивалентов полученного при этом раствора серной кислоты. (Ответ: 0,008 моль/л; 0,016 моль/л). 25.16. Сколько миллилитров концентрированной серной кислоты (ρ = 1,84 г/мл), содержащей 98 % H2SO4, теоретически необходимо для перевода в раствор 10 г меди? Какой объем SO2 (условия нормальные) выделится при этом? (Ответ: 17 мл; 3,52 л). 25.17. Определить молярную концентрацию эквивалентов раствора Na2SO3, если при окислении 20 мл его в кислой среде требуется 16 мл 0,05 н. раствора KMnO4. (Ответ: 0,04 н.). 25.18. Сколько литров Н2S (условия нормальные) потребуется для восстановления в сернокислом растворе 100 мл 5,7 %-го раствора K2Cr2O7 (ρ = 1,04 г/мл)? (Ответ: 1,35 л). 25.19. Какими тремя способами можно получить сероводород, имея в своем распоряжении цинк, серу, водород и серную кислоту? Составить уравнения соответствующих реакций. 25.20. Закончить уравнения реакций окисления концентрированной серной кислотой следующих веществ: а) Zn + H2SO4 = …; б) KI + H2SO4 = …; в) C + H2SO4 = ….
|

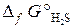 = –33,8 кДж/моль;
= –33,8 кДж/моль;  = –237,3 кДж/моль).
= –237,3 кДж/моль).


