Лабораторная работа. Свойства соединений азота.
Свойства соединений азота. Задания для самостоятельного выполнения: 1. Подготовка презентации «Защита окружающей среды от загрязнений вредными соединениями азота». 2. Составление конспекта «Краткая характеристика свойств фосфора и его важнейших соединений. Фосфорные удобрения». 3. Вычислите объемы (при н.у.) азота и водорода, необходимых для получения17 т аммиака. 4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
5. Методом электронного баланса составьте уравнения следующих реакций:
Форма контроля самостоятельной работы: выполнение и сдача лабораторной и практической работ.
Вопросы для самоконтроля по теме: 1. Какие элементы составляют главную подгруппу пятой группы? Каковы закономерности изменения свойств элементов в подгруппе? 2. Каковы кислотно-основные и окислительно-восстановительные свойства аммиака? 3. Какая реакция является качественной на катион аммония? 4. Какие оксиды образует азот? Назовите их. 5. Какие химические свойства азотной кислоты? 6. Как можно получить азотную кислоту в лаборатории? 7. Выразите химическими уравнениями процесс получения азотной кислоты в промышленности. Тема 2.4 Подгруппа углерода Основные понятия и термины по теме: углерод, аллотропия, угарный газ, углекислый газ, угольная кислота, адсорбция, адсорбент, адсорбат, кремний, кремнивая кислота, силикаты. План изучения темы (перечень вопросов, обязательных к изучению): 1. Характеристика углерода и кремния по положению в периодической системе элементов и строение атомов. Углерод в природе. Аллотропия углерода: алмаз, графит, карбин. Химические свойства углерода. 2. Основные виды технического угля: кокс, древесный уголь, костяной уголь и сажа. Их получение и применение. Активированный уголь. Адсорбция, применение в нефтегазопереработке. 3. Оксид углерода (II). Получение, свойства, применение. Оксид углерода (IV). Получение, свойства, применение. 4. Угольная кислота. Свойства карбонатов и гидрокарбонатов, их применение. 5. Кремний, получение, свойства, применение. Оксид кремния (IV). Кремниевые кислоты, силикаты.
Краткое изложение теоретических вопросов: Среди элементов IV группы наибольшее значение имеют углерод, входящий в состав всех живых организмов, и кремний - важнейший элемент земной коры. Двухвалентные соединения для кремния менее характерны, чем для углерода. Это связано с меньшим значением энергии возбуждения атомов кремния благодаря большей удаленности наружных электронов от ядра. При обычных условиях углерод и кремний очень инертны и практически не взаимодействуют ни с какими простыми и сложными веществами. Исключение составляет аморфный кремний, реагирующий с фтором. При нагревании углерод и кремний взаимодействуют с галогенами, с элементами подгруппы серы, азотом, водородом и многими металлами. В последнем случае образуются соединения, называемые карбидами и силицидами. С углеродом и кремнием взаимодействуют лишь некоторые кислоты, являющиеся сильными окислителями. Углерод. Углерод является главной составной частью всех животных и растительных организмов. Входит в состав природных газов. В свободном состоянии С находится в природе в двух кристаллических формах - алмаза и графита. Алмаз – бесцветное, прозрачное, самое твердое вещество, имеет большую лучепроницаемость и не проводит электрический ток. Графит – серое, незначительно твердое вещество с металлическим блеском, жирное на ощупь, хорошо проводит теплоту и электрический ток. Карбин - чёрный порошок, полупроводник. При нагревании переходит в графит. Химические свойства: 1) с некоторыми металлами образует карбиды
2) с неметаллами: при температуре электрической дуги – с водородом
3) взаимодействие с кислородом
при недостатке кислорода наблюдается неполное сгорание:
4) взаимодействие со фтором
5) взаимодействие со сложными веществами:с водяным паром
6) с оксидами металлов
7) с кислотами – окислителями:
Основные виды технического угля: кокс – твердый продукт, остающийся после прокаливания угля при1000-12000С без доступа воздуха, находит широкое применение в доменных печах при выплавке чугуна; древесный уголь используется как адсорбент для очистки различных веществ от примесей; сажа - продукт неполного сгорания многих органических веществ, она широко используется в резиновой промышленности для изготовления шин. Оксид углерода(II) CO – ядовитый газ, без цвета и запаха, плохо растворяется в воде. Применяется как восстановитель металлов из их оксидов (например, выплавка чугуна), как составная часть газообразного топлива. Получение: 1) действием водяного пара на метан с образованием водяного пара:
Оксид углерода(IV) CO2 - бесцветный, горючий газ, тяжелее воздуха, в воде растворяется незначительно. Применяется для изготовления искусственных минеральных вод и других напитков, для производства соды, мочевины. Получение:
Угольная кислота H2CO3. При растворении оксида углерода (IV) в воде образуется слабая угольная кислота, которая изменяет цвет индикаторов. В свободном состоянии не существует: CO2 + H2O↔H2CO3
Кремний - самый распространенный на Земле элемент. В свободном состоянии не существует. В виде SiO2 входит в состав многих минералов: гранита, глины и т.д. Часто встречается и свободный оксид кремния (VI) в виде песка, кварца. Получение: а) восстановлением кварца в электрической печи углем в присутствии железа, образующийся сплав кремния с железом легко плавится и из расплава кремний выкристаллизовывается; затем железо растворяют в кислотах, остается кристаллический кремний:
Оксид кремния SiO2 - твердое, очень тугоплавкое вещество (температура плавления более 1700 °С), широко распространенное в природе, где оно встречается главным образом в виде минерала кварца, а также кристобалита и тридимита. Кристаллическая форма оксида кремния(IV)-кварц реагирует с HF, щелочами:
Кремниевая кислота - очень слабая кислота. Из водных растворов своих солей кремниевая кислота осаждается в виде бесцветного студня-коллоидного раствора. При высушивании такой кислоты образуется пористый продукт – силикагель, который широко используется в качестве осушителя газов и адсорбентов. Соли кремниевых кислот. В природе больше распространены сложные силикаты, которые можно рассматривать как соли поликремниевых кислот. К природным силикатам относятся: H4Al2Si2O9 (каолин); H4Mg3Si2O9 (асбест) и др. Силикаты можно получить при сплавлении SiO2 с основными оксидами или солями летучих кислот:
|



 Ca3(PO4) CaHPO4 Ca(H2PO4)2
Ca3(PO4) CaHPO4 Ca(H2PO4)2

 а) P P2O5 H3PO4
а) P P2O5 H3PO4
 4Al + 3C Al4C3
4Al + 3C Al4C3 C + 2H2 CH4
C + 2H2 CH4 CH4+H2O CO+3H2
CH4+H2O CO+3H2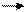 2) пропусканием CO2 над раскаленным углем: CO2+C 2CO
2) пропусканием CO2 над раскаленным углем: CO2+C 2CO 1) при горении угля в избытке кислорода: C+O2 CO2
1) при горении угля в избытке кислорода: C+O2 CO2 2) при разложении карбонатов: CaCO3 CO2 + CaO
2) при разложении карбонатов: CaCO3 CO2 + CaO Как кислота двухосновная, реагирует с сильными основаниями, при этом образуется кислые средние соли: H2CO3 + NaOH NaHCO3 + H2O
Как кислота двухосновная, реагирует с сильными основаниями, при этом образуется кислые средние соли: H2CO3 + NaOH NaHCO3 + H2O SiO2 + 2C 2CO+ Si
SiO2 + 2C 2CO+ Si б) чистый кремний получается при разложении иодида кремния при высокой температуре: SiI4 Si+2I2
б) чистый кремний получается при разложении иодида кремния при высокой температуре: SiI4 Si+2I2 в) в лаборатории получают восстановлением оксида кремния(IV) или галогенидов кремния магнием, алюминием или углем: SiO2 + 2Mg 2MgO + Si
в) в лаборатории получают восстановлением оксида кремния(IV) или галогенидов кремния магнием, алюминием или углем: SiO2 + 2Mg 2MgO + Si SiO2+4HF SiF4+2H2O
SiO2+4HF SiF4+2H2O SiO2+2NaOH Na2SiO3+H2O.
SiO2+2NaOH Na2SiO3+H2O. SiO2 + MgO MgSiO3
SiO2 + MgO MgSiO3


