Лабораторная работа. Свойства соединений металлов I и II групп Периодической системы.
Свойства соединений металлов I и II групп Периодической системы.
Задания для самостоятельного выполнения: 1. Составление конспекта «Жесткость воды и способы ее устранения. Система водоподготовки на предприятиях нефтехимии». 2. Сколько литров водорода (н.у.) образуется при взаимодействии 4,6 г натрия с водой? 3. Какая масса хлорида калия необходима для приготовления 5 л физиологического раствора (ρ=1,01 г/см3)? 4. Напишите молекулярные и ионные уравнения реакций, с помощью которых можно осуществить следующие превращения:
Форма контроля самостоятельной работы: выполнение и сдача лабораторной работы.
Вопросы для самоконтроля по теме:
Тема 2.7 Металлы III и IV групп Периодической системы Основные понятия и термины по теме: оксид и гидроксид алюминия, алюмосиликаты, алюминотермия. План изучения темы (перечень вопросов, обязательных к изучению): 1. Сравнительные характеристики свойств металлов III и IV групп периодической системы: строение атомов, химические свойства. 2. Характеристика важнейших соединений, амфотерный характер оксидов и гидроксидов алюминия, свинца, олова.
Краткое изложение теоретических вопросов: К главной подгруппе III группы периодической системы относятся бор, алюминий, галий, индий, талий. Все эти элементы, кроме бора, металлы. Характерная степень окисления +3. С химической точки зрения металлы активны. Они взаимодействуют с галогенами, серой, образуя соединения со степенью окисления +3. По отношению к воде они ведут себя по-разному: алюминий взаимодействует с водой при нагревании, на галий и индий даже кипящая вода в отсутствии кислорода не действует. К побочной подгруппе III группы периодической системы относятся: скандий, иттрий, лантан, актиний, лантаноиды или лантаниды, следующий в периодической системе за лантаном; актиноиды и актиниды, следующие в периодичсекой системе за актинием. В химических реакциях атомы скандия, иттрия, лантана, актиния отдают по три электрона, вследствие чего элементы подгруппы скандия имеют ярко выраженный металлический характер и обладают довольно высокой активностью: они окисляются во влажном воздухе, превращаясь в соответствующие гидроксиды. Взаимодействуют с большинством неметаллов: с кислородом образуют основные оксиды Ме2О3, плохо растворимые в воде, но легко соединяющиеся с ней с образованием гидроксидов Ме(ОН)3 белого цвета. Главную подгруппу IV группы периодической системы элементов составляют углерод, кремний, германий, олово и свинец. Элементы этой подгруппы образуют оксиды с общей формулой RO и водородные соединения с формулой RH4. От углерода к свинцу свойства оксидов изменяются от кислотных до амфотерных. PbO и SnO являются основными оксидами. От углерода к свинцу уменьшается прочность водородных соединений. Изменяется и характер гидратов. В подгруппе с ростом порядкового номера уменьшается энергия ионизации и увеличивается а томный радиус, т.е. неметаллические свойства ослабевают, а металлические усиливаются. К побочной подгруппе IV группы периодической системы относятся переходные или d-элементы: титан, цирконий, гафний. У всех этих элементов имеется 4 валентных электрона - два d-электрона на предпоследней орбитали и два s-электрона на последней. По физическим свойствам все эти элементы являются металлами с высокой плотностью, похожими на сталь с высокой температурой плавления и кипения. При взаимодействии металлов с парами воды выше 800 0С образуются оксиды типа МеО2 и выделяется водород, ниже этой температуры образуется оксиды (II) и гидриды. Все эти металлы обладают определенной устойчивостью по отношению к кислотам. Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо основные, либо кислотные свойства (то есть проявляющие амфотерность). Образуются пеалехинными металлами. Металлы в амфотерных оксидах обычно проявляют степень окисления от III до IV, за исключением ZnO, BeO, SnO, PbO. Олово и свинец - металлы IV А подгруппы периодической системы Д.И. Менделеева. Свинец при взаимодействии с HCl покрывается слоем PbCl2, препятствующим дальнейшему взаимодействию Pb с кислотой. Аналогично происходит взаимодействие свинца с разбавленной серной кислотой, но при концентрации кислоты выше 80% на поверхности металла образуется растворимая кислая соль Pb(HSO4)2.
Для олова и свинца известны оксиды типов ЭО и ЭО2. В воде они почти не растворимы, поэтому отвечающие им гидроксиды получают действием щелочей на растворы соответствующих солей: SnCl4 + 4NaOH = 4NaCl + Sn(OH)4 Pb(NO3)2 + 2NaOH = 2NaNO3 + Pb(OH)2 По химическим свойствам все эти гидроксиды - амфотерные соединения. Гидроксиды H2SnO2 и H2PbO2 называют оловянистой и свинцовистой кислотами, а их соли - станнитами и плюмбитами. Гидроксиды H2SnO3 (H4SnO4) и H2PbO3 (H4PbO4) называют оловянной и свинцовой кислотами, а их соли - станнатами и плюмбатами. Ввиду слабости основных свойств гидроксидов Э(ОН)4 их соли подвергаются в растворах сильному гидролизу. Алюминий входит в главную подгруппу III группы периодической системы Д.И. Менделеева. Из-за устойчивой оксидной пленки алюминий не растворяется в воде, несмотря на высокое значение электродного потенциала. Оксидная пленка растворяется в кислотах (с трудом) и в щелочах. Оксид алюминия амфотерен.
Алюминий, лишенный защитной пленки, взаимодействует с водой:
Алюминий активно реагирует с кислотами
и с водными растворами щелочей
Гидроксид алюминия Al(OH)3 - типичное амфотерное соединение: свежеприготовленный легко растворяется в кислотах и в щелочах.
|



 NaCl Na NaBr;
NaCl Na NaBr; а) Na2O NaOH
а) Na2O NaOH
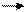

 CaO CaCl2
CaO CaCl2


 Олово и свинец растворяются в щелочах с выделением водорода и образованием комплексных солей: Pb + 4KOH + 2H2O K4[Pb(OH)6] + H2
Олово и свинец растворяются в щелочах с выделением водорода и образованием комплексных солей: Pb + 4KOH + 2H2O K4[Pb(OH)6] + H2 Al2O3 + 6 H+ 2Al+3 + 3H2O
Al2O3 + 6 H+ 2Al+3 + 3H2O


