Лабораторная работа. Свойства соединений металлов III и IV групп Периодической системы.
Свойства соединений металлов III и IV групп Периодической системы.
Задания для самостоятельного выполнения: 1. Подготовка презентации «Применение оксида алюминия, алюмосиликатов, сульфата и хлорида алюминия в нефтепереработке». 2. Напишите уравнения реакций взаимодействия алюминия с простыми веществами: хлором, бромом, серой, азотом, углеродом. Составьте окислительно-восстановительные реакции. 3. Напишите молекулярные и ионные уравнения реакций взаимодействия алюминия со сложными веществами: водой, оксидами, разбавленными кислотами HCI, H2SO4, HNO3; с концентрированной H2SО4 (t); с гидроксидом натрия. 4. С какими из перечисленных веществ: NaOH, Na2O, SO3, H2SO4, Na2SO4 –реагируют Al2O3 и Al(OH)3? Напишите уравнения в молекулярном и ионном виде. 5. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Форма контроля самостоятельной работы: выполнение и сдача лабораторной работы.
Вопросы для самоконтроля по теме:
Тема 2.8 Металлы VI и VII групп Периодической системы Основные понятия и термины по теме: оксиды и гидроксиды хрома, хроматы и дихроматы, оксиды и гидроксиды марганца, манганаты и перманганаты.
План изучения темы (перечень вопросов, обязательных к изучению): 1. Общая характеристика подгруппы хрома. Получение хрома. Характеристика хрома, оксидов, гидроксидов, солей хрома. Амфотерный характер оксида и гидроксида хрома (III). Хроматы и дихроматы 2. Общая характеристика подгруппы марганца. Получение марганца. Характеристика марганца, оксидов, гидроксидов, солей марганца. Манганаты и перманганаты.
Краткое изложение теоретических вопросов: Элементы подгруппы хрома занимают промежуточное положение в ряду переходных металлов. Степень окисления у элементов подгруппы хрома сильно варьирует. В надлежащих условиях все элементы проявляют положительную степень окисления от 2 до 6, максимальная степень окисления соответствует номеру группы. Не все степени окисления у элементов стабильны, у хрома самая стабильная +3. При обычных условиях хром устойчив по отношению к кислороду воздуха и воде. Эта, стабильность обусловлена пассивацией за счет образования на поверхности металла тонкой, но плотной оксидной пленки состава Cr2O3. Если эту пленку разрушить химически, термически или иным способом хром довольно легко окисляется. В отличие от компактного металла порошкообразный хром сгорает в кислороде при нагревании: 4 Cr + 3O2 = 2Cr2O3 При нагревании хром реагирует с галогенами, серой и другими неметаллами, растворяет водород. С большинством металлов образует твердые растворы или интерметаллические соединения.
Свойства оксидов и гидроксидов: +2 +3 +6 оксиды: CrO Cr2O3 CrO3 черный темно-зеленый красный
гидроксисоединения Cr(OH)2 Cr(OH)3 H2CrO4 грязно-зеленый желтый
усиление кислотных свойств. Оксид и гидроксид хрома (II) обладают только основными свойствами и легко растворяются в кислотах с образованием соответствующих солей хрома (II) (в отсутствии кислорода!). Оксид хрома (II) представляет собой порошок черно-зеленого цвета, практически нерастворимый в воде, кислотах, щелочах. Амфотерный характер оксида хрома (III) проявляется при сплавлении Cr2O3 с оксидами и карбонатами щелочных металлов, при этом образуются метахромиты:
Гидроксид хрома (III) обладает амфотерными свойствами и легко растворяется как в избытке сильной кислоты, так и в избытке раствора щелочи. Оксид хрома (VI) кристаллизуется в виде ярко – красных кристаллов при действии концентрированной серной кислоты на раствор дихромата калия K2Cr2O7:
В состав побочной подгруппы VII группы входят марганец Mn, технеций Тс, рений Re. Во внешнем электронном слое атомов этих элементов находятся два электрона. Марганец – твердый хрупкий неблагородный металл; в компактном состоянии серебристо – белого цвета, на воздухе принимает серую окраску вследствие образования оксидного слоя. При нагревании марганец сгорает на воздухе, образуя оксид состава Mn3O4. При нагревании марганец взаимодействует со всеми остальными неметаллами. Водород хорошо растворим в марганце, но химических соединений не образует. В отсутствии пассивирования в мелкодисперсном состоянии марганец при нагревании разлагает воду с выделением водорода. Как активный металл, энергично взаимодействует с неокисляющими разбавленными кислотами. При этом образуются только производные марганца (II) Mn + 2HCl MnCl2 + H2
Оксид и гидроксид марганца (IV) являются амфотерными соединениями. И основная, и кислотная функции выражены у них слабо: в разбавленных растворах кислот или щелочей они практически не растворяются. В концентрированных растворах образуются соли марганца (IV): MnO2 + 2H2SO4 = Mn(SO4)2 + 2H2O MnO2 + 2NaOH +2H2O = Na2[Mn(OH)6] Соли, отвечающие кислотным свойствам Mn(OH)4, называются манганитами, а гидроксид марганца (IV) в этом случае рассматривается как марганцоватистая кислота. Оксид Mn3O4, известный в природе как минерал гаусманит, может быть получен искусственным путем при взаимодействии Mn(OH)4 как кислоты и Mn(OH)2 как основания: 2Mn(OH)2 + Mn(OH)4 = Mn2MnO4 + 4H2O Оксиды и гидроксисоединения марганца в степенях окисления +5 и +6 в индивидуальном состоянии или в растворе не выделены. Однако, в сильнощелочной среде косвенным путем могут быть получены соли соответствующих кислот, например:
манганат
гипоманганат В нейтральной и кислой средах манганаты и гипоманганаты легко диспропорционируют 2K3MnO4 + 2H2O = MnO2 + Na2MnO4 + 4NaOH гипоманганат калия Соединения марганца в высшей степени окисления (+7) – Mn2O7 и HMnO4 проявляют сильнокислотные свойства, по силе сравнимые с соляной кислотой. Они легко реагируют с основаниями, образуя соли – перманганаты.
Задания для самостоятельного выполнения: 1. Подготовка презентации «Применение хрома и его соединений», «Применение марганца и его соединений» 2. Напишите молекулярные и ионные уравнения реакций, с помощью которых можно осуществить следующие превращения:
3. Составьте уравнения окислительно-восстановительных реакций, протекающих по следующим схемам:
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Форма контроля самостоятельной работы: Представление презентации «Применение хрома и его соединений», «Применение марганца и его соединений»
Вопросы для самоконтроля по теме: 1. Дайте общую характеристику элементов подгруппы хрома.
5. Дайте общую характеристику элементов подгруппы марганца.
Тема 2.9 Металлы VIII группы Периодической системы Основные понятия и термины по теме: оксиды и гидроксиды железа, красная кровяная соль, желтая кровяная соль, берлинская лазурь, турнбулева синь, металлургия, коррозия. План изучения темы (перечень вопросов, обязательных к изучению): 1. Общая характеристика подгруппы железа. Характеристика железа, оксидов, гидроксидов, солей железа. Качественные реакции на ионы железа (II) и (III). Применение железа и его соединений. 2. Металлургия. Коррозия металлов.
Краткое изложение теоретических вопросов: В побочную подгруппу восьмой группы входят три «триады» элементов: первую триаду образуют железо, кобальт, никель; вторую - рутений, родий, палладий; третью триаду образуют осмий, иридий, платина. Все элементы группы 8 содержат 8 электронов на своих валентных оболочках. Триада железа. Эти элементы имеют два электрона на наружном слое атома, все они являются металлами. По свойствам все три элемента похожи между собой. Для них характерна степень окисления 2, 3, 4. Реже проявляются более высокие степени окисления. Ни один элемент из семейства железа не проявляет максимальной степени окисления +8. Все металлы триады образуют разнообразные соединения, проявляя степени окисления +2 и +3. Проявление высокой степени окисления и амфотерных свойств характерно для железа. При обыкновенной температуре железо очень медленно окисляется кислородом воздуха. Кобальт и никель более устойчивы, так как покрыты защитными оксидными пленками. В ряду стандартных электродных потенциалов эти металлы стоят левее водорода.
Концентрированные азотная и серная кислоты на холоде пассивируют железо, а при нагревании окисляют его с образованием солей железа (III): Fe + 6HNO3 (конц) = Fe(NO3)3 + 3NO2 + 3H2O Металлы семейства железа образуют оксиды и гидроксиды состава:
Me2O3 Me(OH)3 основных свойств Оксиды и гидроксиды Fe2+ проявляют свойства средних оснований и легко взаимодействует с кислотами с образованием соли металла (II):
Гидроксид железа (II) очень быстро окисляется кислородом воздуха до Fe(OH)3. При действии кислоты на Fe(OH)3 образуется соль Fe3+ и вода, т.е. происходит реакция обмена, в которой гидроксид железа (III) проявляет основные свойства.
Амфотерный характер гидроксида железа (III) чрезвычайно слабо выражен в водных растворах, но при сплавлении с сильными основаниями он образует соли - ферриты: Fe(OH)3 + NaOH = NaFeO2 + 2H2O феррит натрия В растворах соли катионов металлов (Меn+) семейства железа подвергаются гидролизу с образованием кислой среды. Особенно сильно гидролизуется Fe3+:
Коррозия металлов. Коррозией называется разрушение металлов под влиянием окружающей среды в результате химического или электрохимического взаимодействия с ней. Различают два типа коррозии: химическую или электрохимическую. Химическая коррозия обусловливается взаимодействием металлов с сухими газами или жидкостями, не являющимися электролитами. Электрохимическая коррозия – разрушение металла при контакте двух разнородных металлов в присутствии электролита. В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением: 4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3 Многие металлы, в том числе и довольно активные (например, алюминий) при коррозии покрываются плотной, хорошо скрепленной с металлами оксидной пленкой, которая не позволяет окислителям проникнуть в более глубокие слои и потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха. Коррозии подвергаются и некоторые довольно малоактивные металлы. Во влажном воздухе поверхность меди покрывается зеленоватым налетом (патиной) в результате образования смеси основных солей. Иногда при коррозии металлов происходит не окисление, а восстановление некоторых элементов, содержащихся в сплавах. Например, при высоких давлениях и температурах карбиды, содержащиеся в сталях, восстанавливаются водородом. К коррозии металлов можно отнести также их растворение в жидких расплавленных металлах (натрий, свинец, висмут), которые используются, в частности, в качестве теплоносителей в ядерных реакторах. Одним из наиболее эффективных методов борьбы с коррозией является электрохимическая защита. А так же защита одного металла другим, более активным металлом, расположенным в ряду напряжений левее, эффективна и без наложения разности потенциалов. Более активный металл (например, цинк на поверхности железа) защищает от разрушения менее активный металл. Металлургия – это наука о промышленных способах получения металлов. Получение металлов. Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления, значит для того, чтобы их получить, в виде простого вещества, необходимо провести процесс восстановления Ме+n + ne- → Me0 I. Пирометаллургический способ. Это восстановление металлов из их руд при высоких температурах с помощью восстановителей неметаллических - кокс, оксид углерода (II), водород; металлических - алюминий, магний, кальций и другие металлы. 1. Получение меди из оксида с помощью водорода – Водородотермия: Cu +2O + H2 = Cu0 + H2O 2. Получение железа из оксида с помощью алюминия – Алюмотермия: Fe+32O3 +2Al = 2Fe0 + Al2O3 Для получения железа в промышленности железную руду подвергают магнитному обогащению: 3Fe2O3 + H2 = 2Fe3O4 + H2O А затем в вертикальной печи проходит процесс восстановления: Fe3O4 + 4H2 = 3Fe + 4H2O Fe3O4 + 4CO = 3Fe + 4CO2 II. Гидрометаллургический способ. Способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: 1 стадия – CuO + H2SO4 = CuSO4 + H2O, 2 стадия – проводят реакцию замещения более активным металлом CuSO4 + Fe = FeSO4 + Cu. III. Электрометаллургический способ. Это способ получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов: 2NaCl эл.ток→ 2Na + Cl2 2Al2O3 эл.ток→ 4Al + 3O2 IV. Термическое разложение соединений. Например, получение железа: Железо взаимодействует с оксидом углерода (II) при повышенном давлении и температуре 100-2000, образуя пентакарбонил: Fe + 5CO = Fe(CO)5 Пентакарбонил железа-жидкость, которую можно легко отделить от примесей перегонкой. При температуре около 2500 карбонил разлагается, образуя порошок железа: Fe (CO)5 = Fe + 5CO↑ Если полученный порошок подвергнуть спеканию в вакууме или в атмосфере водорода, то получится металл, содержащий 99,98– 99,999% железа.
|




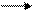 AlCl3 NaAlO2 Al(OH)3
AlCl3 NaAlO2 Al(OH)3 Al Al(OH)3
Al Al(OH)3

 Он медленно взаимодействует с хлороводородной и разбавленной серной кислотами, с образованием водорода и солей хрома (II), которые далее окисляются до хрома (III): Cr + 2HCl CrCl2 + H2; 2CrCl2 + 2HCl 2CrCl3 + H2.
Он медленно взаимодействует с хлороводородной и разбавленной серной кислотами, с образованием водорода и солей хрома (II), которые далее окисляются до хрома (III): Cr + 2HCl CrCl2 + H2; 2CrCl2 + 2HCl 2CrCl3 + H2. основный амфотерный кислотный
основный амфотерный кислотный
 Cr2O3 + Na2O 2NaCrO2; Cr2O3 + Na2CO3 2NaCrO2 + CO2
Cr2O3 + Na2O 2NaCrO2; Cr2O3 + Na2CO3 2NaCrO2 + CO2 Гидроксид хрома (III) получают действием на раствор соли Cr3+ раствором основания например: Cr2(SO4)3 + 6NH4OH 2Cr(OH)3 + 3(NH4)2SO4
Гидроксид хрома (III) получают действием на раствор соли Cr3+ раствором основания например: Cr2(SO4)3 + 6NH4OH 2Cr(OH)3 + 3(NH4)2SO4 K2Cr2O7 + H2SO4 K2SO4 + 2CrO3 + H2O
K2Cr2O7 + H2SO4 K2SO4 + 2CrO3 + H2O Все оксиды, кроме высшего Mn2O7, являются твердыми ионно–ковалентными соединениями и с водой не взаимодействуют. Поэтому соответствующие гидроксиды получают косвенными путем. Например, Mn(OH)2 образуется в виде студнеобразного, осадка розового “телесного” цвета действием щелочей на водные растворы солей марганца (II): MnCl2 + 2NaOH Mn(OH)2 + 2NaCl
Все оксиды, кроме высшего Mn2O7, являются твердыми ионно–ковалентными соединениями и с водой не взаимодействуют. Поэтому соответствующие гидроксиды получают косвенными путем. Например, Mn(OH)2 образуется в виде студнеобразного, осадка розового “телесного” цвета действием щелочей на водные растворы солей марганца (II): MnCl2 + 2NaOH Mn(OH)2 + 2NaCl 2KMnO4 + K2SO3 + 2KOH 2K2MnO4 + K2SO4 + H2O
2KMnO4 + K2SO3 + 2KOH 2K2MnO4 + K2SO4 + H2O KMnO4 + K2SO3 + 2KOH K3MnO4 + K2SO4 + H2O
KMnO4 + K2SO3 + 2KOH K3MnO4 + K2SO4 + H2O Mn2O7 + 2NaOH 2NaMnO4 + H2O
Mn2O7 + 2NaOH 2NaMnO4 + H2O HMnO4 + NaOH NaMnO4 + H2O
HMnO4 + NaOH NaMnO4 + H2O



 б) Cr Cr2O3 CrCl3 Cr(OH)3 Cr2(SO4)3.
б) Cr Cr2O3 CrCl3 Cr(OH)3 Cr2(SO4)3.

 С разбавленными соляной и серной кислотами железо взаимодействует с выделением водорода и образованием солей железа (II) Fe + 2HCl FeCl2 + H2
С разбавленными соляной и серной кислотами железо взаимодействует с выделением водорода и образованием солей железа (II) Fe + 2HCl FeCl2 + H2 MeO Me(OH)2 усиление
MeO Me(OH)2 усиление Fe(OH)2 + 2HCl FeCl2 + 2H2O
Fe(OH)2 + 2HCl FeCl2 + 2H2O
 I ст. Fe3+ + H2O FeOH2+ + H+
I ст. Fe3+ + H2O FeOH2+ + H+ II ст. FeOH2+ + H2O Fe (OH)2+ + H+
II ст. FeOH2+ + H2O Fe (OH)2+ + H+



