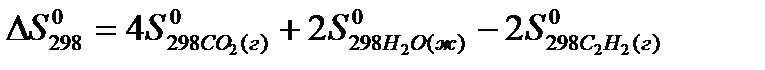Задачи для самостоятельной работы
Задача 1. Сколько теплоты будет потеряно за день при выделении через кожу 576г воды, если на испарение 1 моля воды требуется 40 кДж? Ответ:1280 кДж Задача 2. Одним их путей метаболизма глюкозы в организме является процесс: С6Н12О6 (р-р) → С3Н7СООН (ж) + 2СО2(г) + 2Н2(г). Рассчитайте тепловой эффект этого процесса. Ответ:DН= - 58,2 кДж Задача 3. В 100 граммах бисквитного десерта содержится 5,5 г белка, 24 г жира и 54 г углеводов. Вычислите калорийность десерта массой 80 г. Ответ:372,7 ккал Задача 4. Вычислите стандартную энтропию реакции окисления сахарозы С12Н22О11(к) + 12О2(г) → 12СО2(г) + 1Н2О(ж), используя справочные данные. Ответ:DS0р-ции = 518 Дж/моль×K Задача 5. Вцикле Кребсацитрат превращается в изоцитрат, а затем в a-кетоглутарат. Рассчитайте величину ΔG для этих реакций, используя справочные данные, определите направление протекания каждого из процессов: 1) Цитрат3- → Изоцитрат3- 2) Изоцитрат3- + ½О2(г) + Н+ ↔ a-кетоглутарат2- + Н2О(ж) + СО2(г) Ответ:ΔG1 р-ции = 6,6 кДж/моль, ΔG2 р-ции = - 267,2 кДж/моль Задача 6. Вычислите стандартную энтальпию образования глюкозы, воспользовавшись необходимыми для этого стандартными энтальпиями сгорания: С6Н12О6 + 6О2 → 6СО2+6Н2О Ответ: DН0обр. = - 1267 кДж/моль Задача 7. Вычислите энергию Гиббса тепловой денатурации трипсина при 500С, если DН0р-ции= 283 кДж/моль, а DS0р-ции= 288 Дж/моль×K. Считать, что изменение энтальпии и энтропии не зависят от температуры в данном диапазоне. Ответ:ΔG = 190 кДж/моль Задача 8. Для реакции синтеза аммиака из простых веществ равновесные концентрации при некоторой температуре равны С(NН3) = 4 моль/л, С(N2) = 3 моль/л, С(Н2) = 9 моль/л. В каком направлении будет идти реакция при концентрации всех реагентов, равных 5 моль/л. Ответ подтвердите расчётами. Ответ:Пс >;Кс, ΔG >;0, равновесие смещено в сторону исходных веществ. Задача 9. Рассчитайте константу равновесия реакции гидролиза сложноэфирной связи при температуре 310К, если DG0 = -10,48 кДж/моль. Ответ: Кс = 58,7 Задача 10. Для реакцииН2О(г)+СО(г)↔ СО2(г)+Н2(г) константы равновесия равны при 8000С К= 2,87, а при 10000С К=1,39. Вычислите тепловой эффект реакции по уравнению изобары. Ответ: DН = - 41,1 кДж/моль.
Тестовые вопросы 1. Если энтальпия образования SO2 равна -297 кДж/моль, то количество теплоты, выделяемое при сгорании 16г серы, равно ____кДж. 1) 148,5 2) 297 3) 594 4)74,25 2. В реакции, протекающей в соответствии с термохимическим уравнением 3H2 + N2 = 2 NH3 + 92 кДж, выделилось 23 кДж теплоты. Объём полученного (при н.у.) аммиака равен____. 1) 5,6 л 2) 11,2л 3) 22,4л 4) 44,8л 3. По термохимическому уравнению реакции С2Н4 + Н2О ↔ С2Н5ОН +46 кДж вычислите объём взятого этилена (н,у.), если известно, что выделившаяся в этом процессе теплота составила 138 кДж. 1) 44,8 л 2) 22,4л 3) 67,2 4) 89,6л 4. В реакцию, протекающую в соответствии с термохимическим уравнением 2Al + 3S = Al2S3 +509 кДж вступило 108 г алюминия. Количество выделившейся теплоты равно____. 1) 242,5 кДж 2) 509 кДж 3) 1018 кДж 4) 2036 кДж 5. В результате реакции, термохимическое уравнение которой 2Al +Fe2O3 = Al2O3 + 2 Fe +848 кДж, выделилось 169,6 кДж теплоты. Масса образовавшегося железа равна_____. 1) 11,2 г 2) 22,4 г 3) 56 г 4) 28 г 6. По термохимическому уравнению реакции горения ацетилена 2С2Н4 + 5О2 = 4СО2 + 2Н2О +2610 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило 67,2 л ацетилена (н.у.) 1) 870 кДж 2) 3915 кДж 3) 5220 кДж 4) 7830 кДж 7. В результате реакции, термохимическое уравнение которой 2С2Н4+ 5О2 = 4СО2 + 2Н2О +2610 кДж выделилось 652, 5 кДж теплоты. Объём сгоревшего ацетилена равен 1) 11,2 л 2) 22,4 л 3) 44,8 л 4) 67,2 л 8. Какое выражение соответствует константе химического равновесия для данной реакции N2+3H2 = 2NH3 1) Kc = [NH3]2/ [N2]+[H2]3 3) Кр = [NH3]2 / [N2][H2] 2) Кс = [NH3]2 / [N2][H2]3 4) Кс = []N2][H2]3/ [NH3]2 9. Как нужно изменить давление, чтобы реакция гемоглобина с кислородом Hb + O2 «HbO2 была смещена вправо? 1) уменьшить давление 2) увеличить давление 3) давление не влияет 10. Какое значение константы равновесия соответствует данной реакции 2NO +O2 «2NO2 1) Kc= [NO2]2/ [NO][O2] 3) Kc= [NO][O2]/ [NO2]2 2) Kc= [NO2]2 / [NO]2[O2] 4) Kc= [NO2]/ [NO][O2] 11. Как нужно изменить давление реакции N2+3H2 «2 NH3, чтобы сместить равновесие вправо? 1) уменьшить 3) не изменять 2) увеличить 4) увеличить давление NH3 12. Будет ли влиять давление на смещение равновесия данной реакции H2 + Cl2 = 2 HCl? 1) будет 2) нет 3) сместит равновесие вправо 4) сместит равновесие влево 13. Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в обратном направлении? 1) DG0 < 0 2) DG0 > 0 3) DG0 = 0 4) DG0 = 1
14. Равновесие в реакции, уравнение которой СН4(г) + 4S(ж) ↔ СS2(г) + 2Н2S(г), ΔH<0, сместиться влево при ______. 1) понижении давления 3) дополнительном введении серы 2) понижении температуры 4) увеличении концентрации H2S 15. Будет ли протекать реакция в прямом направлении, если DG = 18 кДж/моль? 1) нет 2) химическое равновесие 3) будет 16. Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направлениях: 1) СO2(г) + C(т) ↔ 2СО(г), ΔН<0 2) J2(г) + 5 СО2(г) ↔ J2O5(т) + 5СО(г), ΔН>0 3) N2(г) + О2(г) ↔ 2 NO(г), ΔН>0 4) С2Н2(г) + 2Н2(г) ↔ С2Н6 (г), ΔН<0 17. Как нужно изменить давление, чтобы равнеовесие реакции гемоглобина с кислородом былаосмещено влево Hb + O2 «HbO2? 1) уменьшить давление 2) увеличить давление 3) давление не влияет 18. В реагирующей системе, уравнение которой NO(г) + Cl2(г) ↔ NOCl2(г) ΔH > 0, равновесие сместиться вправо при_____. 1) повышении давления 3) понижении температуры 2) использовании катализатора 4) повышении концентрации NOCl2 19. Для смещения равновесия в системе SO2(г)+Cl2(г) 1) понизить температуру 3) понизить концентрацию SO2 2) понизить давление 4) ввести катализатор 5) повысить температуру 20. На состояние химического равновесия в системе 2SO2(г) + О2 (г) ↔2 SO3, ΔH0 < 0 не влияет____ 1) катализатор 3) изменение температуры 2) изменение концентрации исходных веществ 4) изменение давления 21. Для нахождения 1) 2) 3) 4) 22. Для нахождения 2) 3) 4)
|

 SO2Cl2(г), DH°<0 в сторону продуктов реакции необходимо_____,
SO2Cl2(г), DH°<0 в сторону продуктов реакции необходимо_____, реакции
реакции  , следует воспользоваться формулой:
, следует воспользоваться формулой:

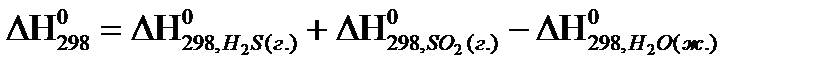

 реакции
реакции 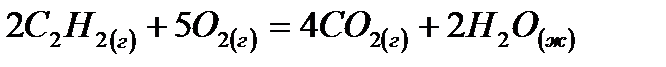 следует воспользоваться формулой:1)
следует воспользоваться формулой:1)