Занятие 1.1.3
ТЕМА: Растворы. Коллигативные свойства растворов. ЦЕЛЬ:Изучить коллигативные свойства растворов и приобрести навыки криометрических измерений. ЗНАТЬ: 1. Растворы, определение. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обуславливающие ее роль в качестве единственного биорастворителя. Строение воды, образование межмолекулярных водородных связей. 2. Концентрация растворов, способы ее выражения. Массовая доля, молярная концентрация, моляльная концентрация, молярная концентрация эквивалента, молярная доля и титр. 3. Зависимость растворимости вещества в воде от соотношения гидрофильных и гидрофобных свойств; влияние внешних условий на растворимость. 4. Понятие об идеальном растворе. 5. Закон Рауля и следствия из него: понижение температуры замерзания, повышение температуры кипения раствора. 6. Коллигативные свойства разбавленных растворов неэлектролитов. 7. Коллигативные свойства разбавленных растворов электролитов. 8. Осмос. Омотическое давление: закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов. 9. Понятие о изоосмии. Роль осмоса в биологических системах. Плазмолиз, гемолиз. 10. Законы растворения газов в воде и биологических жидкостях. УМЕТЬ: 1. Самостоятельно пользоваться учебной, научной и справочной литературой. 2. Пользоваться химическим оборудованием (термометром, прибором для криометрических измерений, химической посудой и т.д.). 3. Наблюдать за протеканием физических процессов и делать обоснованные выводы. 4. По экспериментально найденному понижению температуры замерзания раствора рассчитать изотонический коэффициент и осмотическую концентрацию. 5. Рассчитывать давление пара над раствором, температуру кипения, замерзания, осмотическое давление растворов электролитов и неэлектролитов, молярную массу вещества эбулиометрическим и криометрическим методом. 6. Уметь применять законы Генри, Дальтона и Сеченова при лечении кессонной болезни, лечении в барокамере и исследовании электролитного состава крови. ВЛАДЕТЬ: 1. Навыками самостоятельной работы с учебной и справочной литературой. 2. Навыками безопасной работы в химической лаборатории. 3. Навыками оформления результатов и выводов экспериментальных работ. Лабораторная работа №2 «Определение осмотической концентрации и изотонического коэффициента раствора электролита»
Основные уравнения по теме: «Растворы. Коллигативные свойства растворов»
1. массовая доля (%)
2. молярная концентрация (моль/л)
где,
4. моляльная концентрация (моль/кг)
5. молярная доля
6. объёмная доля
7. титр (г/мл) 8. P = P0× c (X1) закон Рауля
9.
10. ∆Р = Р0×χ(Х2) закон Рауля
11. DTк = Кэ × b(x) - повышение температуры кипения растворов 12. D Tз = Кз × b(x) - понижение температуры замерзания растворов 13.
методом 14. методом 15. p осм. = С(х) × RT - уравнение Вант-Гоффа 16. 17. Уравнения коллигативных свойств растворов электролитов: 1. DP = i P0 c (X2) 2. DTкип = i ×Кэ ×b (х) 3. DTзам = i ×Кз × b (x) 4. p осм. = i ×C(х) ×R×T
|

 Способы выражения концентрации растворов:
Способы выражения концентрации растворов:
 3. молярная концентрация эквивалента (моль/л)
3. молярная концентрация эквивалента (моль/л)






 закон Рауля
закон Рауля расчёт молярной массы вещества эбулиометрическим
расчёт молярной массы вещества эбулиометрическим расчёт молярной массы вещества криометрическим
расчёт молярной массы вещества криометрическим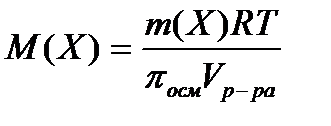 осмометрическое определение молярной массы вещества.
осмометрическое определение молярной массы вещества. - расчет изотонического коэффициента
- расчет изотонического коэффициента


