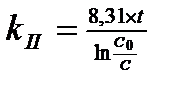Задачи для самостоятелього решения
Задача 1. Как изменится скоростьпрямой реакции2СО(г) + О2(г) ↔ 2 СО2(г) при увеличении концентрации СО в 3 раза. Ответ: увеличится в 9 раз Задача 2. Константа скорости гидролиза атропин-основания при 400С равна 0,316с-1.Массовая доля атропин-основания в растворе была 2,5%. Спустя какое время значение массовой доли останется равным 0,1%? Ответ: 10,175 с Задача 3. Из 1 кг сахарозы при превращении её в глюкозу и фруктозу в присутствии воды и фермента, сахарозы за 5 часов осталось 0,6 кг. Какое количество сахарозы останется через 2ч. 20 мин. Определите время полураспада. Ответ: 79%, 6,8 часа. Задача 4. При авариях на АЭС появляется радиоактивный изотоп йода 131I. За какое время этот изотоп распадётся на 99%? Период полупревращения 131I равен 8,054 сут. Ответ:через 53,5 сут. Задача 5. При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий-192. Какая часть введённого радионуклида останется в опухоли через 90 суток, если его распад подчиняется кинетическому уравнению 1-го порядка? Период полураспада иридия-192 составляет 74,08 суток. Ответ:43% Задача 6. Во сколько раз уменьшится скорость окисления глюкозы при гипотермии, если температура тела падает с 36,60С до 270С, температурный коэффициент данной реакции равен 1,3. Ответ:в 1,29 раза Задача 7. При повышении температуры от 250С до 450С скорость реакции возросла в 7 раз. Определить температурный коэффициент реакции. Ответ:γ=2,65 Задача 8. Денатурация вируса – реакция первого порядка с энергией активации 630 кДж/моль. Период полупревращения при 300С равен 5 ч. Рассчитайте период полупревращения при 370С. Ответ:63 с Задача 9. В 1952 г в организм человека попал радионуклид стронций-90. В каком году его останется 40%. Период полураспада 90Sr=28,7 года. Ответ: в 1990 г Тестовые вопросы 1. При 0°С гранула железа растворяется в соляной кислоте за 20 мин. Если температурный коэффициент реакции равным 2, то такой же по массе кусочек железа растворится при 20°С за _____ минут. 1) 5 2) 12 3) 60 4) 10 2. Если температурный коэффициент скорости химической реакции равен 2, то при повышении температуры от 200С до 500С скорость реакции____. 1) увеличивается в 8 раз 3) уменьшается в 2 раза 2) увеличивается в 6раз 4)уменьшается в 4 раза 3. Температурный коэффициент реакции равен 3. Во сколько раз увеличивается скорость реакции при повышении температуры на 200С? 1) в 1,5 раза 2) в 3 раза 3) в 6 раз 4) в 9 раз 4. Кинетическое уравнение для реакций I-го порядка имеет вид: 1) 2) 5. Кинетическое уравнение для реакций II-го порядка имеет вид: 1) 2) 6. Согласно закону Вант-Гоффа при повышении температуры на 10ºС скорость химической реакции возрастет в______. 1) 5-6 раз 2) 2-4 раза 3) 10 раз 4) 1,75 раза 7. Энергия активации – это ____. 1) кинетическая энергия 2) потенциальная энергия 3) энергия, образующаяся при столкновении молекул 4) избыточная энергия, которую необходимо передать 1 моль вещества, чтобы перевести все молекулы в активное состояние 8. Как изменится скорость химической реакции при увеличении температуры на 20ºС? При температурном коэффициенте равном 4________. 1) возрастет в 16 раз 3) сначала увеличится в 3 раза, затем уменьшится в 1,5 раза 2) уменьшится в 2 раза 4) не изменится
|

 3)
3) 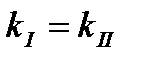
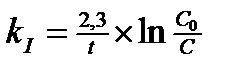 4)
4) 
 3)
3) 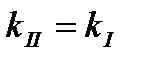
 4)
4)