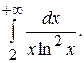Эквивалент. Закон эквивалентов. Несобственные интегралы
Несобственные интегралы 5.2. Исследовать сходимость и вычислить сходящиеся интегралы. 1) 5)
СБОРНИК ЗАДАЧ И УПРАЖНЕНИЙ По курсу «ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ» (для студентов I курса) (под ред. А.А.Мачулы)
ОБНИНСК 2002 Сборник задач и упражнений по курсу «Общая и неорганическая химия».Под редакцией А.А.Мачулы. Издание второе, исправленное и дополненное. - Обнинск, ИАТЭ, 2002, - 154 С.
Учебное пособие содержит задачи и упражнения по 11 основным темам, подобранным в соответствии с современной программой курса химии для инженерно-технических специальностей вузов. Каждый раздел содержит необходимое теоретическое введение и примеры решения задач и упражнений. Авторы пособия А.АМачула, О.А. Ананьева, С.Б. Бурухин, В.А. Колодяжный, Т.Е.Ларичева, Н.Н. Панкова, Ю.Д.Соколова.., Пособие предназначено для самостоятельной работы студентов нехимических специальностей вузов.
Рецензенты: д.х.н., профессор В.К.Милинчук, к.х.н. Ю.М.Глушков
Темплан 2002, поз.
ã Обнинский институт атомной энергетики, 2002 г. ã А.А.Мачула, 2002 г.
Эквивалент. Закон эквивалентов Эквивалентом называют реальную или условную частицу вещества х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода. Фактор эквивалентности (f(x)) - это число, обозначающее, какая доля реальной частицы вещества х эквивалентна одному иону водорода в данной кислотно-основной реакции. f(x) - безразмерная величина, f(x) может быть равен или меньше единицы. Молярная масса эквивалента вещества х (Э(x)) (или эквивалентная масса) - это масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х: Э(х) = f(x) × М(х). Молярная масса эквивалента выражается в г/моль. Факторы эквивалентности для сложных веществ определяются по формулам: f(оксида) = 1/[(число атомов элемента)×(валентность элемента)]; f(кислоты) = 1/основность кислоты; f(основания) = 1/кислотность основания; f(соли) = 1/[(число атомов металла)×(валентность металла)]; Для простых веществ f= 1/[(число атомов в молекуле)×(валентность атома)].
Примечания 1. Основностью кислоты называется число атомов водорода в одной молекуле кислоты, которое может принимать участие в химической реакции. 2. Кислотностью основания называется число ОН - групп в одной молекуле основания, которое может принимать участие в химической реакции. Пример 1 Вычислить эквивалентные массы H2SO4, CaO, Ca(OH)2, Al2(SO4)3: 1) Э(H2SO4) = 1/2×98 = 49 г/моль; 2) Э(СаО) = 1/2×56 = 28 г/моль; 3) Э(Са(ОН)2) = 1/2×74 = 37 г/моль; 4) Э(Al2(SO4)3)= 1/(2×3)×342 = 57 г/моль.
Для определения эквивалентной массы элемента необязательно исходить из его соединения с водородом. Эквивалентную массу можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен. Закон эквивалентов:массы реагирующих веществ относятся между собой как эквивалентные массы этих веществ: mA/mв = ЭА/Эв или mA/ ЭА = mв/ Эв, где mA/ ЭА = N1; mв/ Эв = N2 - количество эквивалентов вещества А и В, поэтому можно записать N1 = N2. Следовательно, возможна другая формулировка закона эквивалентов: вещества реагируют друг с другом в равных количествах эквивалентов. При соединении элементов друг с другом и при замещении одних элементов другими в качестве постоянных принято считать эквивалентную массу кислорода, равную 8 г/моль, и водорода, равную 1 г/моль. Пример 2 При окислении 2,81 г кадмия получено 3,21 г оксида кадмия. Вычислить эквивалентную массу кадмия. Решение mo = 3,21 г - 2,81 г = 0,4 г - масса кислорода. Из закона эквивалентов 2,81/0,4 = Э(Сd)/8 Þ Э(Сd) = 2,81× 8/0,4 = 56,2 г/моль.
Пример 3 Для реакции между магнием и кислотой взято 0,183 г Mg. Получено 182,7 мл водорода при 20оС и 750 мм ртутного столба. Вычислить эквивалентную массу Mg. Решение Р=750/760×1,013×105=1×105 Па; Т=273+20=293 К; V=182,7×10-6 м3, М=2 г/моль. По уравнению Менделеева-Клапейрона вычисляем массу водорода исходя из его объема: m(H2)=p×V×M/(R×T)=1×105×182,7×10-6×2/(8,31× 293)=0,015 г. Из закона эквивалентов 0,183/0,015 = Эmg/1 Þ Эmg = 0,183 × 1/0,015 = 12,2 г/моль.
Эквивалентная масса элемента представляет собой частное от деления атомной массы элемента (А) на его валентность в данном химическом соединении: Э(х) = А/n, где А - атомная масса элемента, n - валентность элемента. Пример 4 Вычислить валентность хрома в оксиде, имеющем состав Cr - 68,42 %, O - 31,58 %. Решение По закону эквивалентов находим эквивалентную массу хрома: mСr/mо = ЭCr/Эо Þ ЭСr = 68.42 × 8/52 = 17.3 г/моль. Затем производим вычисления валентности: Э=А/n Þ n(Cr) = 52/17,3 = 3.
|

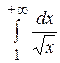 ; 2)
; 2)  ; 3)
; 3)  ; 4)
; 4) 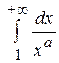 ,
, 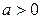 ;
; ; 6)
; 6) 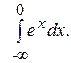 ; 7)
; 7)