ОБРАБОТКА ОТФОРМОВАННЫХ ИЗДЕЛИЙ
К весьма значительному технологическому переделу, влияющему на структурообразование ИСК, как и других материалов, относится специальная обработка отформованных и уплотненных изделий с помощью одного, двух или большего количества внешних воздействий на материал в некотором последовательном или комбинированном порядке. Обработка может быть тепловой, тепловлажностной, химической, электрофизической, автоклавной, вакуум-пропиточной, радиационной (нередко совмещаемой с вакуум-пропиточной) и др. Основная цель обработок — обеспечить развитие процессов микро- и макроструктурообразования с возможно более полным переводом систем из метастабильного и мута-бильного состояний в термодинамически устойчивое. И хотя соответствующие процессы могут продолжаться и после произведенной обработки, в том числе в эксплуатационный период работы конструкции, однако их лавинная доля протекает на стадии обработки, реже — на стадии выдерживания изделий в обычных, «нормальных» условиях. Эффективность обработки характеризуется постепенным или быстрым упрочнением структуры свежеизготовленных изделий с переходом ее в твердое или твердообразное состояние. Отвердевает в основном вяжущая часть, поскольку другая — заполняющая -часть конгломерата состоит из смеси уже твердых компонентов. В вяжущей части формируется либо одна, новая фаза, либо их может быть несколько. Новая фаза в виде химических соединений, возникающих под влиянием хемосорбционных реакций на поверхности твердых частиц или в растворе (расплаве), вначале появляется как скопление микрозародышей; в последующий период проходит кинетическое развитие центров реакции. Продукты химических реакций выделяются в самостоятельную фазу, концентрация которой со временем нарастает.
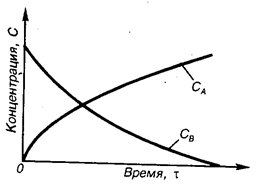
Рис. 2.9. Зависимость концентрации С веществ В и А от времени
Истинная скорость v химической реакции (в отличие от средней скорости) в данный момент времени является первой производной от концентрации (С) по времени (τ;), т. е. v = ±dС/dτ;. Знак в первой производной зависит от характера концентрации, а именно: минус — для одного из исходных компонентов, концентрация которого со временем снижается (dС/dτ; <0); плюс — для одного из продуктов реакции, концентрация которого со временем растет (dС/dτ; >0). На рис. 2.9 кривая Св соответствует первому случаю, а кривая Cа — второму. При сложных реакциях с участием в них двух и более простых реакций каждая из последующих протекает самостоятельно и к каждой из них применимы уравнения кинетики простых реакций. Скорость химических реакций быстро возрастает с повышением температуры согласно уравнению Аррениуса:
ln k = А/Т + В, (2.6)
где А и В — индивидуальные постоянные для данной реакции; Т — абсолютная температура по шкале Кельвина; А — константа скорости реакции, по величине является обратной скорости реакции. Величина А по физическому смыслу пропорциональна энергии активации: А = Е*/R, где Е* — энергия активации, под которой понимается избыточное количество энергии (по сравнению со средним ее значением), которым обладает молекула в момент эффективного столкновения с другой при образовании химического взаимодействия; R — газовая постоянная). Из уравнения следует, что константа скорости (k) реакции (а следовательно, и скорость реакции) изменяется с колебаниями температуры сильнее в тех реакциях, которые имеют повышенную энергию активации. При незначительной энергии активации скорость реакции слабо изменяется с ростом или падением температуры. Чтобы повысить энергию реагирующих молекул, т. е. активировать их, используют различные методы, назначаемые с учетом: природы веществ, кинетической энергии; повышения энергии взаимного колебания атомов в молекуле; повышения энергии движения электронов в атомах, например в результате разрывов валентных связей (в частности, при диссоциации молекул на атомы, поглощении электромагнитных колебаний и др.); активацией молекул с помощью электрического разряда; воздействия ультразвуковых колебаний и излучений, например световых потоков высоких энергий — рентгеновских, гамма-излучений и др. Количественная зависимость скорости реакций от температуры выражается также приближенным правилом Вант—Гоффа, согласно которому при повышении температуры на 10°С скорость химических реакций увеличивается в 2—4 раза. Число, показывающее во сколько раз увеличивается скорость, называется температурным коэффициентом скорости реакции. Это правило возможно выразить формулой
где v1 и v2 — скорости реакций при температурах соответственно t1 и t2; γ; — температурный коэффициент скорости реакции. Скорость химических реакций зависит не только от температуры, но и от концентрации реагирующих веществ. В простейших случаях, когда имеются гомогенные реакции и протекают они в сильно разбавленных растворах (или в среде идеального газа), функционирует закон действия масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций (с) реагирующих веществ, возведенных в степени их стехиометрических коэффициентов. Так, например, 2H2 + O2 = 2H2О, а Не всегда с помощью регулирования концентраций реагирующих веществ и повышения температуры достигается желаемое ускорение технологического процесса на производстве. Большого эффекта можно достигнуть действием на реакционную систему катализатором излучений и других факторов. В качестве катализаторов используют различные вещества, но специфичность их воздействия заключается в том, что каждая реакция ускоряется каким-то определенным катализатором, который не способен ускорять другие реакции, т. е. катализатор реакций участвует таким образом, что выходит на завершающей стадии в своем начальном виде и количестве. Действие катализатора приводит к образованию дополнительного количества химических соединений в единицу времени с увеличением объема новой фазы, чаще всего кристаллической. Кроме химических реакций, к образованию новой фазы приводит кристаллизация растворенного вещества из пересыщенного раствора. Пересыщение возникает по разным причинам: удаление части жидкой дисперсионной среды, например при выпаривании или испарении воды, спирта, эфиров или других растворителей; изменение температуры насыщенного раствора (обычно при ее понижении); изменение внешнего давления; химическое взаимодействие исходных компонентов в сложном растворе и др. Самое сильное влияние оказывает понижение температуры, поскольку растворимость многих веществ тогда падает, хотя некоторые вещества все же характеризуются и отрицательным коэффициентом растворимости, т. е. их растворимость снижается с повышением температуры раствора. В сложных растворах пересыщение часто связано с образованием новых химических соединений. Пересыщенный раствор обладает сравнительно небольшой термодинамической устойчивостью. Его переход в относительно устойчивое состояние могут вызывать посторонние факторы: внесение «затравки» в виде мелкого кристаллика, укрупненных молекул, мицелл или при особом сочетании ионов растворенного вещества, взвешенных пылинок инородного тела, а также под влиянием механического воздействия, особенно ударного. Без инициирующих факторов метастабильное состояние системы может сохраняться длительное время; большая энергия активации, большой тепловой эффект и другие факторы затрудняют переход системы в устойчивое насыщенное состояние. Тогда возможна высокая степень перенасыщения раствора прежде чем из него самопроизвольно выделятся «зародыши» новой фазы. По современным воззрениям, сначала появляются зародыши новой фазы в виде скопления малого числа атомов, образования ассоциаций частиц при столкновениях в растворе отдельных ионов (молекул) растворенного вещества. На последующей стадии рост зародышей приводит к появлению дискретных частиц субмикроскопических размеров. Но частицы-зародыши продолжают пока находиться в подвижном равновесии и видимой кристаллизации не происходит. Этот период характеризуется как скрытый, индукционный. Скорость образования субмикроскопических зародышей возрастает с повышением температуры, при перемешивании раствора, при механических внешних воздействиях (встряхивание, вибрация, ударение, трение и т. п.), в присутствии твердых включений с большой поверхностью (зерна, нити, ленты и др.). В кристаллизующуюся систему нередко вводят так называемые кренты — кристаллизационные компоненты-добавки, выполняющие функции затравок микрозародышей. Кренты способствуют интенсификации твердения (например, цементного теста) и улучшению качества микроконгломерата. На определенном этапе частицы-зародыши достигают критического размера, при котором каждая обладает достаточной поверхностной энергией, чтобы вызвать дополнительное адсорбирование частиц растворенного вещества. Увлекаются и мельчайшие твердые частицы других веществ, находящихся в системе, в том числе частиц новообразований. Зародыши становятся, таким образом, 'центрами кристаллизации. Последние выделяются сначала в виде аморфных частичек, которые обычно с большой скоростью переходят в кристаллическое состояние с укрупнением за счет наслоения вещества на гранях кристалликов. По мере увеличения размера кристаллов окружающая фаза становится пересыщенной и, следовательно, неустойчивой по отношению к крупным кристаллам, но ненасыщенной для мелких и мельчайших кристалликов. Согласно принципу Гиббса—Кюри, каждый кристалл при своем росте принимает такую форму, при которой суммарное значение его поверхностной энергии имеет наименьшее значение, т. е. ∑σ∙S = σ1∙S1 + σ2∙S2 +... → min при v = const, где v — объем кристалла; S — поверхность различных граней кристалла; σ — их поверхностное натяжение. Чем ближе величины поверхностной энергии граней между собой, тем1 ближе многогранник к сферической форме, а при весьма редко встречающихся случаях, когда поверхностная энергия граней одинакова, т. е. σ1∙S1 = σ2∙S2 =,..., σn∙Sn, кристалл принимает форму шара. При других зависимостях скорости роста от реальных условий кристаллизации возможно образование иных форм и структуры кристаллов — многогранных, пластинчатых, игольчатых, дендритовых (древовидных) и т. д. Не остается постоянной растворимость кристаллического вещества, возрастая с повышением его дисперсности. При контакте с насыщенным раствором крупные кристаллы еще более укрупняются за счет растворения мелких. В результате этого непрерывного процесса крупные кристаллы сравнительно быстро могут достичь размера, при котором поверхностные силы этой части кристаллов (кристаллических агрегатов и сростков) практически перестают влиять на общее равновесие системы. Такое состояние крупных кристаллов (сростков) адекватно как бы выходу фазы из системы. Вследствие этого появляются условия для нового пересыщения раствора и возникновения зародышей новой фазы, образования новых, возрастающих по размеру кристаллов до следующего выхода кристаллических сростков из этой метастабильной системы. Повторение такого рода периодических циклов приводит к полному переводу раствора в кристаллическое состояние. Скорость спонтанного перенасыщения до возникновения зародышей новой фазы и кристаллизации спадает при понижении температуры, а при достаточно большом переохлаждении раствора скорость становится ничтожно малой. Тогда некоторые жидкости переходят в стеклообразное состояние с мало упорядоченным расположением частиц и избыточным запасом внутренней энергии. Возникновение и рост кристаллов и кристаллических агрегатов могут происходить также из газообразного состояния вещества, минуя жидкую фазу, например при резком понижении температуры или резком повышении давления. Такой своеобразный вид кристаллизации за счет возгонки (сублимации) и последующего охлаждения и конденсации газа (десублимации) является характерным для некоторых ИСК, в которых присутствуют газы или пары, например нафталина, воды, хлористого магния, аммонийных солей и др. Но процесс десублимации нередко отсутствует, и тогда из строительного конгломерата (например, на основе дегтевого вяжущего вещества) удаляется кристаллическая фаза путем необратимой возгонки с частичной потерей положительных свойств материала, например плотности, прочности. На свойства кристаллов оказывают влияние не только форма, размер или природа кристаллизующегося вещества. Так, например, примесь поверхностно-активных веществ в растворе в очень небольших количествах может приостановить рост кристаллов даже при высоких степенях пересыщения раствора или, наоборот, способствовать их росту. Формированию крупных кристаллов способствует медленный их рост и небольшие степени пересыщения. Перемешивание при кристаллизации благоприятствует диффузионному переносу вещества к граням кристаллов и их росту, но вместе с тем вызывает образование зародышей и, следовательно, накопление мелких кристаллов. Разные режимы вибрации в технологии вносят свои существенные коррективы в процесс кристаллизации. В обжиговых конгломератах вяжущей частью служат расплавы как своеобразные разновидности химических растворов, обусловленных определенными внешними факторами. Переход из жидкого в твердое состояние при охлаждении происходит также под влиянием кристаллизации компонентов. В более редких случаях происходит постепенный переход из жидкого состояния в твердое, аморфное, стеклообразное, т. е. жидкость становится переохлажденной. Переохлаждение жидкости легче протекает при отсутствии в ней посторонних взвешенных твердых частиц, растворенных газов или пузырьков воздуха, а также при полном покое. Внесение твердой частицы того же вещества или тем более кристаллика приводит к незамедлительному процессу кристаллизации переохлажденного расплава с превращением его полностью в кристаллическое состояние. При этом молекулы перестраиваются из хаотического беспорядка в упорядоченное, обуславливаемое кристаллической решеткой. Процесс кристаллизации из расплавов начинается и заканчивается при определенных температурах, что зависит от входящих в расплав компонентов. В расплаве может происходить самопроизвольная кристаллизация сначала в отдельных точках, создавая анизотропную структуру, а затем заполняя постепенно весь объем. Для каждого вещества имеется оптимальная температура, при которой создается наибольшее количество центров кристаллизации. При более высокой температуре происходит дезориентация молекул, случайно получающих организованное кристаллическое состояние, а при пониженных температурах возрастает вязкость, препятствуя перемещению молекул и их правильной ориентации в системе с формированием кристаллов. Оптимальные температуры образования наибольшего количества центров кристаллизации при остывании расплава не совпадают, как правило, с наибольшей скоростью кристаллизации, смещаясь относительно друг друга. К большинству расплавов, которые в качестве связующего вещества участвуют в образовании ИСК, применим всеобщий закон эвтектики. Сущность его состоит в стремлении расплава к такой смеси компонентов, при которой обеспечивается переход расплава при застывании в твердое состояние при самой низкой, эвтектической, температуре. Расплавы начинают кристаллизоваться с того компонента, который имеется в расплаве в избытке, самопроизвольно сбрасывая избыток этого компонента в виде кристаллической фазы и приближая остаток расплава к составу эвтектики, которая и достигается при понижении температуры. Фазовый состав образующихся кристаллических веществ определяется диаграммами состояния. Когда компоненты расплава нерастворимы между собой, то температуры начала кристаллизации следуют по линиям, пересекающимся в точке. Она характеризуется эвтектической температурой и эвтектическим составом. В этой точке при строго определенном фазовом составе может существовать как жидкая, так и твердая эвтектика, т. е. отвердевание расплава происходит при постоянной температуре. Для тех сплавов, в которых компоненты обладают некоторой взаимной растворимостью, характерно образование твердого состояния по линии солидуса с кристаллами как чистых компонентов, так и содержащих небольшие количества растворенного в них другого твердого компонента. В системах могут появляться новые соединения, возникающие в результате химического взаимодействия исходных компонентов. Некоторые новые кристаллические соединения могут обладать температурой плавления более высокой, чем температуры плавления чистых компонентов. Для таких сложных систем на общих диаграммах состояний появляются две эвтектические точки, так как кроме двух обычных чистых компонентов появляется средняя промежуточная, соответствующая новому химическому соединению с более высокой температурой его плавления. Подобные соединения между компонентами в различных системах образуются сравнительно часто, а при расплавлении они переходят в жидкий расплав того же состава (конгруэнтное плавление) или же кристаллическое соединение при плавлении обратимо разлагается, образуя жидкость другого состава и новую твердую фазу (инконгруэнтное плавление). Если в физико-химической системе имеется не два, как было отмечено выше, а три компонента и более, то процесс кристаллизации расплава при постепенном снижении температуры еще более усложняется. В этой системе появляется эвтектика, состоящая из трех или большего числа компонентов. Могут возникать новые химические соединения с характерными для них температурами плавления, твердые растворы и т. п. Возникают многообразные системы, состав которых наиболее полно изучают с помощью дифференциально-термического анализа и других физических методов. Как отмечалось, расплав переходит в твердое состояние постепенно или быстро, что зависит от внешней температуры, выделяя кристаллы переменного состава, и только в эвтектике возникает мгновенно твердое состояние расплава, т. е. сплав. Возможно, однако, что в исходном состоянии расплав уже имел кристаллы, не перешедшие при данной температуре нагрева системы в жидкое состояние. Тогда общая масса остывает в присутствии этих кристаллов, переходящих в затвердевший материал в виде вкраплений, весьма характерных для так называемых порфировых структур горных пород. Если расплав остывает быстро, то процессы кристаллизации полностью не успевают пройти, а в получаемом твердом веществе сохраняется в том или ином количестве стекловатая часть (стекло). В расплавах, как и в обычных растворах, нередко присутствует газовая фаза, которая образуется или в ходе химических реакций как основной или промежуточный продукт, или под влиянием испарения отдельных ингредиентов, находясь в смеси в виде пара, или вследствие возгонки (сублимации), минуя переход в жидкое состояние. В результате возникают твердые системы с включением в их поры газовой фазы. При изменении параметров среды (давления и температуры) физико-химическая система может перейти из установившегося устойчивого равновесия, соответствующего правилу фаз Гиббса, в неустойчивое с возможным выделением новых твердых фаз, изменением фазового состава и структуры. В этом отношении менее устойчивыми являются кристаллы, деформированные стесненными условиями их роста, а также кристаллические тела в измельченном состоянии в виде осколков кристаллов. Тогда вещество обладает большей химической активностью и меньшей химической стойкостью, большей способностью к фазовым превращениям, большей растворимостью и др. Аморфное состояние всегда менее устойчиво по сравнению с кристаллическим. Многие вещества способны существовать в различных модификациях, т. е. имеют склонность к полиморфизму при повышении или понижении температуры (обжиг, охлаждение). Процессы кристаллизации при формировании структур ИСК являются наиболее типичными. В идеализированных условиях кристаллы образуются из закономерно расположенных в них микрочастиц — атомов, ионов, молекул. Характер этой закономерности расположения микрочастиц обусловлен составом вещества, а связи между частицами кристалла могут быть разнообразными, в том числе комбинированными по разным частям тела. Кристаллы с ионной связью (ионной решеткой) обладают сравнительно высокими температурами плавления. Ионная связь характеризуется тем, что ионы связи обусловлены электростатическим притяжением противоположно заряженных ионов (катионов, анионов). При ковалентной связи кристаллы обладают обычно высокой твердостью, весьма высокими температурами плавления. Направленная ковалентная связь выражается & том, что тесно сближенные атомы передают один или большее число электронов на образование устойчивых наружных электронных оболочек, с помощью которых и осуществляется между ними связь. Ковалентная связь может быть неполярной, когда взаимодействующие атомы принадлежат сравнительно одинаковым элементам, и полярной, когда электронная оболочка (электронная пара), связывающая атомы, принадлежит им не в одинаковой степени, а как бы смещена к одному из них, находясь большее время около него. Полярная связь относится к промежуточной между ионной (в ней тоже как бы образуется электронная пара) и неполярной связями. Кристаллы с молекулярными кристаллическими решетками обладают сравнительно низкими температурами плавления, малой твердостью, значительной летучестью, особенно органические соединения (например, нафталин и др.). Кроме кристаллов с типичными формами связи, включая металлические, существуют переходные и смешанные формы связи. В состав ионных кристаллов могут входить, например, некоторые нейтральные молекулы, располагающиеся между ионами или слоями ионов (например, молекулы воды). Имеются и другие отклонения в структуре и химическом составе кристаллов с появлением дефектов, посторонних атомов и ионов в виде примесей внедрения и примесей замещения. В реальных условиях неизбежно появляются причины к изменениям внешней формы и внутреннего строения кристаллов, что оказывает сильное влияние на их свойства, особенно на механическую прочность. Еще большее влияние на свойства оказывает характер установившегося контакта и связей между отдельными кристаллами, особенно, когда они состоят не из одного, а из двух, трех и большего числа их видов, например, в твердых сплавах или в продуктах кристаллизации из сложных растворов. Значительное влияние на прочность, деформативность и другие свойства оказывает контактирование кристаллов или их обломков через тонкие прослойки инородного вещества, нередко находящегося в стеклообразном состоянии. Стеклообразные вещества характеризуются, во-первых, изотропностью (большинство кристаллов отличаются анизотропно стью, т. е. векториальностью свойств) и, во-вторых, способностью при нагревании переходить постепенно в жидкое состояние. Известно, что кристаллическое вещество полностью переходит в жидкое состояние при одной, характерной для него постоянной температуре. Возможен самопроизвольный переход вещества из стеклообразного в кристаллическое состояние, сопровождаемый выделением в небольших количествах теплоты, преодолением энергетического барьера, связанного с образованием вокруг частиц двойных адсорбционных и ионных оболочек, прослоек среды повышенной вязкости. В технологии этот барьер нередко преодолевается наложением дополнительных механических воздействий на твердеющую систему. В различных видах вяжущего вещества устанавливаются после отвердевания системы определенные соотношения объемов кристаллической и аморфной (стеклообразной) фаз, которые под действием эксплуатационных факторов могут претерпевать отклонения как за счет дополнительного выделения новообразований, так и за счет упорядочения в расположении частиц (атомов, ионов, молекул) стекловатой фазы с постепенным переходом ее в кристаллическое, в той или иной мере деформированное, состояние. К процессам структурообразования и сопутствующим им явлениям относятся также контракция и усадка, экзотермический и эндотермический эффекты, релаксации и ретардации. Контракция состоит в самопроизвольном сжатии системы с уменьшением ее первоначального объема в основном в связи с образованием новых химических соединений (химическая усадка) с переходом некоторой доли объемной (свободной) жидкой среды в химически связанное состояние. Поскольку продукт реакции является, как правило, новой фазой микро- и макроструктуры, то возникающая пористость (контракционная) оказывает существенное влияние на качество этой материальной системы. При высокой реагирующей способности компонентов формирующегося сложного материала контракция может составлять до 30% и более общего объеме микродисперсных пор (мельче 0,1 мкм). С усложнением состава вяжущего вещества и повышением тонкости его помола растет суммарный объем контракционных пор. Усадка — уменьшение в объеме, которое происходит под влиянием сжимающих капиллярных сил, перехода твердых компонентов в жидкое состояние с последующим заполнением пор и пустот жидкой средой, испарения части жидкой среды или ее синерезиса (выпо-тевания), снижения температуры (охлаждения), в том числе вследствие эндотермического эффекта. Общая усадка состоит из физической и химической усадок. В отдельных материальных системах вместо усадки наблюдается разуплотнение с увеличением объема конгломерата или вяжущей части. Это явление происходит вследствие: набухания, полиморфно го превращения, химического или физико-химического присоединения большого количества жидкой среды с увеличением в объеме аморфных или кристаллических новообразований, расширения объема при повышении температуры, в частности за счет экзотермических эффектов. В результате усадки и набухания, тем более повторяющихся в технологический период изготовления конгломерата или в эксплуатационный период, нередко возникают самопроизвольные напряжения в материале и, как следствие, микротрещинообразование с возможным ухудшением физико-механических свойств строительных изделий. Различными приемами — регулированием режима отвердевания, введением дополнительных компонентов в смесь и др. — удается уменьшить или полностью исключить влияние усадочных напряжений или деформаций, связанных с разуплотнением структуры. Тепловые эффекты обусловлены химическими реакциями и физическими модификациями. Эндотермические эффекты возникают при разрушениях кристаллической решетки или испарении жидкости, полиморфных превращениях (инверсии) вещества. Экзотермические эффекты и реакции обусловливаются образованием новых фаз, сопровождаются поглощением газовой среды, переходом неустойчивого аморфного состояния в кристаллическое. Релаксация и ретардация — соответственно процессы самопроизвольного снижения напряжения при фиксированной деформации и изменения деформации при фиксированном внутреннем напряжении. То и другое происходит под влиянием перемещений атомов, ионов, молекул, отдельных звеньев молекулярных цепей. В структурообразовании ИСК эти спонтанные процессы имеют как положительное (снятие избыточных напряжений с предотвращением трещинообразования), так и отрицательное значение (ослабление прочности некоторых соединений в конструкциях, разупрочнение конструкции вследствие спада ранее приложенных напряжений в армирующих элементах, например в предварительно напряженных железобетонных конструкциях). Во всех случаях эти процессы и характеризующие их параметры (время релаксации, коэффициент релаксации и др.) учитывают в расчетах ползучести и прочности элементов строительных конструкций. Таким образом, комплекс сложных процессов и явлений, возникающих и развивающихся в период технологических переделов до определенного уровня, а затем постепенно угасающих (в обжиговых ИСК быстрее, чем в безобжиговых), позволяет получать изделие из подготовленных и отдозированных компонентов. Подавляющее количество процессов и явлений из этого комплекса характерно для вяжущей части конгломерата, поскольку именно ее компоненты к моменту объединения, находясь в твердом, жидком или газообразном состоянии, наиболее активны. Структурообразование искусственного конгломерата условно возможно расчленить на множество более простых процессов и явлений, подобно тому как сложные химические реакции представляют собой определенное — параллельное или последовательное — сочетание простых реакций. Преобладающую роль в структурообразовании играют процессы, обеспечивающие формирование и отвердевание вяжущей части, т. е. микроструктуры конгломерата. На стадии макроструктурообразования особая роль принадлежит процессам взаимодействия по границам раздела структурных элементов с отвердеванием всей системы ИСК и с оформлением готового изделия. Структура такого изделия отныне становится единой, монолитной (см. 2.2.5). В расчетных схемах ее нередко, но условно представляют как состоящую из микро- и мак-роструктурных частей. Чтобы технологические переделы были эффективными, а качество продукции — более высоким, обосновывают их оптимальные режимы и параметры на всех основных стадиях производства. Обычно их устанавливают опытным путем, хотя этот метод становится не достаточным при возрастании габаритов выпускаемой продукции. Поэтому вводят определенные расчетные модели, в которых имитируют состояние и поведение реальных конгломератных смесей (масс). Основной реологической характеристикой в этих расчетах и исследованиях служит вязкость предельно разрушенной или полностью ненарушенной структуры (ньютоновские вязкости), а также частично разрушенных структур (структурная, или бингамовская вязкость). Вторая реологическая характеристика — предельное напряжение сдвига — позволяет описывать уравнением напряженное состояние смеси (массы) при оптимизации технологических режимов и параметров. Спонтанно протекающим в технологическом процессе переделом является отвердевание конгломератной системы, в первую очередь ее вяжущей части. Но отвердевание, являясь комплексом сложных процессов, остается мало доступным для визуальных наблюдений. Поэтому ниже предложена гипотетическая общая теория отвердевания ИСК.
|

 (2.7)
(2.7)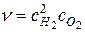 . Этот известный в химии закон лежит в основе химической кинетики, но при сложных реакциях его действие становится менее надежным.
. Этот известный в химии закон лежит в основе химической кинетики, но при сложных реакциях его действие становится менее надежным.


