Молекулярные кристаллы
К молекулярным кристаллам относят твердые тела, в узлах кристаллической решетки которых располагаются либо одинаковые молекулы с насыщенными связями (H2, Сl2, Вг2, I2), либо атомы инертных газов (Аг, Ne, Кг, Хе, Rn). К группе инертных газов следовало бы также отнести и гелий. Однако силы взаимодействия между атомами гелия настолько слабы (энергия сцепления без учета нулевых колебаний составляет всего лишь 0,75-10-3 эВ), а квантово-механическая энергия атомов по сравнению с этими силами настолько велика, что эта энергия является преобладающей. Это обстоятельство приводит к тому, что при нормальном давлении гелий остается жидким вплоть до0К. Для того чтобы перевести гелий в твердое состояние, требуется давление 2,5. 106 Па, Одной из характерных особенностей молекулярных кристаллов является то, что частицы (атомы, молекулы) в кристалле удерживаются вместе очень слабыми силами Ван-дер-Ваальса. Энергия, сцепления молекулярных кристаллов очень мала и составляет 0,02—0,15 эВ (сравните с энергией сцепления ионных кристаллов: так для NaCl энергия сцепления порядка 8 эВ). Такие небольшие энергии сцепления обусловливают очень низкие температуры плавления этих кристаллов. Наличие сил Ван-дер-Ваальса отражает тот факт, что нейтральный изотропный атом (нейтральная молекула) может поляризоваться под влиянием электрического поля, причем даже два нейтральных изотропных атома индуцируют друг в друге малые дипольные электрические моменты. Происхождение сил Ван-дер-Ваальса можно объяснить исходя из следующих простых соображений, В атомах инертных газов внешние электроны образуют очень прочные устойчивые группировки из восьми электронов в состояниях s2р6, вследствие чего на движение электронов слабо влияет присутствие соседних атомов. В среднем распределение заряда в изолированном атоме имеет сферическую симметрию (рис.3.2), положительный заряд ядра равен отрицательному заряду всех электронов, окружающих ядро, атом является электрически нейтральным, и центры зарядов лежат в центре ядра.
Если два таких атома находятся относительно далеко друг от друга, то они не взаимодействуют между собой (рис 3.2). При сближении атомов подвижный отрицательный заряд (облако) одного из атомов в какой-то момент времени может оказаться смещенным,так что центры положительных и отрицательных зарядов уже не будут совпадать, в результате возникнет мгновенный дипольный электрический момент. Такое разделение зарядов (флуктуация) может возникать из-за увеличения энергии атома, например, в результате столкновения с другой частицей. Таким образом, в каждый отдельный момент времени атом может обладать отличным от нуля дипольным электрическим моментом, хотя в среднем по времени этот момент равен нулю. Мгновенный дипольный момент атома создает в центре другого атома электрическое поле, которое наводит в нем также мгновенный дипольный момент, т. е. и в этом атоме происходит разделение зарядов. Таким образом, по мере приближения двух атомов друг к другу их стабильная конфигурация становится эквивалентной двум электрическим диполям (рис 3.3).
Так как притяжение более близких друг к другу противоположных зарядов (рис.3.2) увеличивается при сближении сильнее, чем отталкивание более далеких одноименных зарядов, то результатом будет притяжение атомов друг к другу. Квантово-механический расчет этих сил притяжения для системы из двух идентичных гармонических осцилляторов,находящихся на расстоянии т один от другого, был выполнен Г. Лондоном (1930). Было получено, что полная энергия двух взаимодействующих осцилляторе уменьшается из-за взаимодействия на величину, обратно пропорциональную шестой степени расстояния между ними:
где Поляризуемость, как известно, определяет также оптические свойства кристаллов, в частности дисперсию света (изменение скорости света и показателя преломления среды в зависимости от частоты), поэтому молекулярные силы иногда называют дисперсионными. Молекулярные силы действуют не только между атомами инертных газов, но и между любыми другими атомами, когда они находятся достаточно близко друг к другу, т. е. так, что движение электронов в соседних атомах не претерпевает радикального изменения, а только испытывает слабое возмущение. При дальнейшем уменьшении расстояния между атомами электронные оболочки начинают перекрываться и между атомами возникают значительные силы отталкивания. Отталкивание в случае инертных газов, главным образом, появляется в результате действия принципа запрета Паули. При перекрывании электронных оболочек электроны первого атома стремятся частично занять состояния второго. Поскольку атомы инертных газов имеют стабильные электронные оболочки, в которых все энергетические состояния уже заняты, то при перекрытии оболочек электроны должны переходить в свободные квантовые состояния с более высокой энергией, так как, согласно принципу Паули, электроны не могут занимать одну и ту же область пространства без увеличения их кинетической энергии. Увеличение кинетической энергии приводит к увеличению полной энергии системы двух взаимодействующих атомов, а значит, и к появлению сил отталкивания. Для того чтобы суммарный потенциал типа (3.5) имел минимум, необходимо, чтобы на малых расстояниях потенциал сил отталкивания был больше потенциала сил притяжения. Принято потенциал сил отталкивания представлять в форме степенного закона: U от = Ь/rn, где показатель n равен 12, хотя такой показатель не имеет столь надежного обоснования, как показатель 6 в потенциале сил притяжения, однако выражение Uот = Ь/r12 представляет простое и хорошее приближение. Теперь полную потенциальную энергию взаимодействия между двумя атомами, находящимися на расстоянии rij друг от друга, можно записать в виде
где а и Ь — положительные постоянные. Обычно вместо (3.7) для описания взаимодействия электрически нейтральных атомов и электрически нейтральных и неполярных молекул используют потенциал Леннарда — Джонса:
Потенциал (3.8) зависит от двух параметров:
|


 , (3.6)
, (3.6) — собственная частота простого гармонического осциллятора;
— собственная частота простого гармонического осциллятора; 
 — постоянная Планка;
— постоянная Планка;  — поляризуемость осциллятора (атома); Р — дипольный момент; Е— напряженность электрического поля; а — постоянная.
— поляризуемость осциллятора (атома); Р — дипольный момент; Е— напряженность электрического поля; а — постоянная. (3.7)
(3.7) (3.8)
(3.8) и
и  Параметр
Параметр 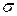 соответствует межатомному расстоянию,при котором полная потенциальная энергия равна нулю, а параметр
соответствует межатомному расстоянию,при котором полная потенциальная энергия равна нулю, а параметр  имеет размерность энергии и равен минимуму потенциальной энергии при
имеет размерность энергии и равен минимуму потенциальной энергии при  . Расстояние
. Расстояние 


