Электронная структура атома углерода и химические связи. Взаимное влияние атомов в молекулах органических соединений
Строение молекул органических соединений в значительной степени определяется валентным состоянием атомов углерода. Поэтому прежде всего рассмотрим эти состояния, исходя из валентной группировки электронов и валентных атомных орбиталей (АО) элемента углерода.
При образовании химических связей атом углерода, как правило, использует четыре валентных орбитали (одну s- и три р-АО), переходя в возбужденное состояние.
С 2s22p2 + 400кДж/моль — С* 2s2 2р3,Рх Ру Pz
Если допустить, что при образовании молекулы метана СН4 участвуют исходные орбитали возбужденного атома углерода, перекрываясь с s-орбиталями атомов водорода, то в получившейся молекуле одна связь С-Н (за счет участия s-s АО) должна быть неравноценной остальным трем связям С-Н (за счет участия s-p АО), поскольку s-орбиталь по энергии и форме отличается от р-орбитали. В действительности все связи в молекуле СН4 равноценны и последняя имеет форму правильного тетраэдра, в центре которого размещается ядро углерода, а в вершинах - ядра атомов водорода. Чтобы объяснить равноценность образующихся связей в подобных молекулах, была выдвинута гипотеза гибридизации (смешения) атомных орбиталей (Л.Полинг, Ж. Слейтер, 1931). В данном случае в образовании молекулы СН4 участвуют со стороны атома углерода "не чистые" s- и р-орбитали, а гибридные. Гибридизацией орбиталей называется процесс выравнивания их по форме и энергии. sр3-гибридизация – 1 валентное состояние атома углерода. Происходит смешение одной 2s- и трех 2р-орбиталей, ведущее к возникновению четырех одинаковых гибридных орбиталей. Они и участвуют в образовании равноценных связей с АО водорода. Процесс смешения одной s- и трех р-орбиталей получил название sp3-гибридизации. Такое состояние атома углерода в его соединениях называется первым валентным состоянием. Во всех предельных углеводородах атомы углерода находятся в sp3-гибридизации. Число гибридных орбиталей равно числу исходных орбиталей. По сравнению с ними гибридные орбитали более вытянуты в пространстве, что обеспечивает их более полное перекрывание с орбиталями соседних атомов. В молекуле метана и в других алканах, а также во всех органических молекулах по месту одинарной связи атомы углерода будут находиться в состоянии sр3-гибридизации, т. е. у атома углерода гибридизации подверглись орбитали одного s- и трех р-электронов и образовались четыре одинаковые гибридные орбитали.
В результате перекрывания четырех гибридных sр3-орбиталей атома углерода и s орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана с четырьмя одинаковыми а-связями под углом 109°28'. Процесс гибридизации, как и возбуждение атома углерода требует затраты энергии. s+р3 + 255 кДж/моль→ sр3 Таким образом на возбуждение атома углерода и гибридизацию АО требуется 655 кДж/моль. Образование молекулы метана из атомов сопровождается выделением энергии, которая с избытком компенсирует затраченную: С(sр3) + 4Н(s) → СН4 +2317 кДж/моль. Образование связей С-Н в молекуле метана происходит в направлении sр3-гибридных орбиталей атома углерода путем их перекрывания с 1-s-орбиталями атома водорода.
sр2-гибридизация – 2 валентное состояние атома углерода При следующем типе гибридизации происходит смешение опять же одной 2s –орбитали и только 2 р-орбиталей, в результате образуются три sр2-гибридные орбитали. Они равноценны, четвертая 2рz орбаиталь остается негибридной, такому атому углерода соответствует второе валентное состояние. Гибридные орбитали располагаются в одной плоскости и также как в случае sр3-гибридизации, симметрично относительно друг друга под углом 120 градусов.
Комбинацию σ и π связей называют двойной связью. sр-гибридизация – 3 валентное состояние атома углерода Встречается третий тип гибридизации sр –гибридизация, то есть смешение только одной 2s –орбитали и одной 2р –орбитали. Образуются 2 равноценные, линейно расположенные (под углом 180 градусов) гибридные орбитали. Две остальные орбитали остаются гантелеобразными. Они располагаются во взаимноперпендикулярных плоскостях, такое состояние углерода встречается в непредельных ацетиленовых углеводородах
|

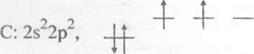



 В результате этого перекрывания увеличивается электронная плотность в поле ядер взаимодействующих атомов, что и обуславливает сближение ядер этих атомов на расстояние, называемое длинной связи. Соединив между собой ядра атомов водорода, получим правильный тетраэдр, в центре которого находится ядро атома углерода. Химическая связь, обусловленная однократным перекрыванием орбиталей вдоль линии, соединяющей ядра взаимодействующих атомов (линии связи), получила название σ-связи. Это ординарная связь, двухядерная и двухцентровая. σ-связь возникает не только между атомами углерода и водорода, но и между С-С атомами, например в молекуле этана.
В результате этого перекрывания увеличивается электронная плотность в поле ядер взаимодействующих атомов, что и обуславливает сближение ядер этих атомов на расстояние, называемое длинной связи. Соединив между собой ядра атомов водорода, получим правильный тетраэдр, в центре которого находится ядро атома углерода. Химическая связь, обусловленная однократным перекрыванием орбиталей вдоль линии, соединяющей ядра взаимодействующих атомов (линии связи), получила название σ-связи. Это ординарная связь, двухядерная и двухцентровая. σ-связь возникает не только между атомами углерода и водорода, но и между С-С атомами, например в молекуле этана.
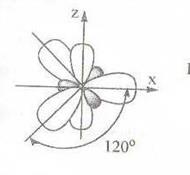 За счет второго валентного состояния образуются непредельные этиленовые УВ.σ-связи в них образуются гибридными орбиталями. Перекрывание негибридных рz орбиталей происходит в плоскости, перпендикулярной плоскости σ-связи. Эти орбитали перекрываются двукратно вне линии связи, в результате чего между углеродными атомами возникает π-связь. При образовании этой связи перекрываются р-АО не в межъядерном пространстве, а вне его. Такое боковое перекрывание оказывается менее эффективным, чем осевое, и, следовательно π-связь менее прочная, чем σ.
За счет второго валентного состояния образуются непредельные этиленовые УВ.σ-связи в них образуются гибридными орбиталями. Перекрывание негибридных рz орбиталей происходит в плоскости, перпендикулярной плоскости σ-связи. Эти орбитали перекрываются двукратно вне линии связи, в результате чего между углеродными атомами возникает π-связь. При образовании этой связи перекрываются р-АО не в межъядерном пространстве, а вне его. Такое боковое перекрывание оказывается менее эффективным, чем осевое, и, следовательно π-связь менее прочная, чем σ.
 .
.


