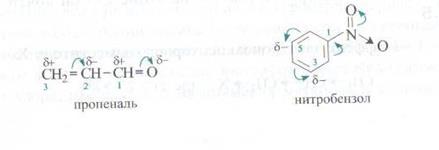Взаимное влияние атомов в молекулах.
Локализованные связи – ковалентные связи, в образовании которых участвуют электроны, принадлежащие двум атомам, когда молекулярная орбиталь охватывает более двух ядер атомов, говорят об образовании делокализованной связи. Молекулы с такой связью относят к сопряженным системам. Сопряжение – наличие в молекуле делокализованного электронного облака в результате перекрывания негибридных р-орбиталей. Выделяют π,π и р,π- сопряжения. Сопряженные системы первого типа образуются с участием р-орбитали двух и более π – связей, разделенных одной σ. Пример бутадиен -1,3. Тип р,π сопряжения осуществляется в случае, когда р-орбитали, образующие двойную или тройную связь перекрываются с р-орбиталью соседнего атома – чаще всего кислорода или азота или галогенов.
Отдельно можно выделить сопряженные системы с замкнутой цепью. Для них свойственно понятие ароматичность. Правило Хюккеля (1931): 1. Соединение представляет собой ароматическую систему в том случае, если число электронов, участвующих в сопряжении в цикле, равно 4n+2, где n = 0 или целое положительное число. 2. Молекула имеет циклическое строение, все атомы цикла во втором валентном состоянии, 3. Сигма скелет молекулы плоский По характеру химической связи все реагенты можно разделить на три типа: с неполярными связями типа А:А, полярными типа По силе индуктивного эффекта заместители располагаются в следующий ряд: NO2>CN>F>Cl>Br>I>COOH>OH>NH2>H<CH3<C2H5<н.алкил<изо-С3Н7<трет. С4Н9 Влияния заместителя, передающееся по сопряженной системе, называется мезомерным эффектом (М). Также может быть + и -.
|

 (0,133 нм, 0,154 нм). Делокализация – энергетически более выгодный процесс, поэтому эти системы обладают меньшим запасом энергии, они более устойчивы, чем изолированные системы. Выйгрыш энергии при делокализации – энергия сопряжения.
(0,133 нм, 0,154 нм). Делокализация – энергетически более выгодный процесс, поэтому эти системы обладают меньшим запасом энергии, они более устойчивы, чем изолированные системы. Выйгрыш энергии при делокализации – энергия сопряжения.
 :
:  , и ионными А+В-:. Рассмотрим молекулу метана, в которой один из атомов водорода замещен на атом хлора, СН3-Сl (хлористый метил) и СН3-Li (метиллития). Связи С – Сl и С-Li полярны. На связанных атомах углерода сосредоточены разные по знаку частичные (эффективные заряды). Частично положительный в первом случае, и ч. + во втором. Наблюдается сдвиг электронной плотности по σ – связи. Более ЭО атом является электроноакцептором, а его партнер по связи – электронодонором. Введенному заместителю приписывают так называемый индуктивный эффект. Смещение электронной плотности в молекуле, вызванное электроноакцепторным или электроноакцепторным заместителем, называют индуктивным эффектом этого заместителя (I). Индуктивный эффект быстро распространяется по всем сигма – связям молекулы и его эффект постепенно ослабевает.
, и ионными А+В-:. Рассмотрим молекулу метана, в которой один из атомов водорода замещен на атом хлора, СН3-Сl (хлористый метил) и СН3-Li (метиллития). Связи С – Сl и С-Li полярны. На связанных атомах углерода сосредоточены разные по знаку частичные (эффективные заряды). Частично положительный в первом случае, и ч. + во втором. Наблюдается сдвиг электронной плотности по σ – связи. Более ЭО атом является электроноакцептором, а его партнер по связи – электронодонором. Введенному заместителю приписывают так называемый индуктивный эффект. Смещение электронной плотности в молекуле, вызванное электроноакцепторным или электроноакцепторным заместителем, называют индуктивным эффектом этого заместителя (I). Индуктивный эффект быстро распространяется по всем сигма – связям молекулы и его эффект постепенно ослабевает.